Данилів С.І.
Прикарпатський
національний університет імені Василя Стефаника
Бактерицидна активність сироватки крові
Cyprinus carpio L. як біомаркер імунотоксичності іонів хрому (VI)
Водні об’єкти України забруднені переважно нафтопродуктами,
фенолами, органічними речовинами, сполуками азоту та важкими металами. У
природні води хром потрапляє з промислового виробництва корозійних інгібіторів
та пігментів, що потім стають забруднювачами водних екосистем та вражають водні
організми [4]. Важкі метали поглинаються фітопланктоном, по харчовому ланцюгу передаються більш
високоорганізованим організмам і поглинається ними. Хром (VI) швидко проникає крізь зяброві мембрани і швидко
акумулюється в різних тканинах, включаючи мозок, гастро-інтестінальний тракт,
нирки, селезінку, шлунок [5]. Хром може
змінювати опірну здатність організму до інфекційних захворювань, оскільки має
вплив на гуморальну та клітинну ланки імунної відповіді [2].
В ході дослідження було
використано 25 особин Cyprinus carpio L. обох статей. Контрольних особин витримували
96 год у звичайних умовах акваріуму, дослідним у воду додавали сіль біхромату
калію (К2Сr2O7): концентрація Cr6+ становила 1 та 2,5 мг/л, час експозиції – 96 годин. Під
впливом вказаних концентрацій іонів шестивалентного хрому вивчали активність мієлопероксидази,
бактерицидну активність сироватки крові, титр гетерофільних антитіл, концентрації
С-реактивного білку та фібриногену сироватки крові. Всі показники визначали
спектрофотометрично згідно стандартних методик [1, 3, 6, 7].
Іони шестивалентного хрому суттєво
впливають на показники неспецифічної резистентності Cyprinus carpio L. У концентрації 2,5 мг/л хром (VI) спричиняє зниження
активності мієлопероксидази в 1,5 рази у порівнянні з меншою концентрацією (1,0
мг/л), де вона становила 0,920 OD 450 nm; бактерицидна активність сироватки крові
при вищій дозі складала 74,58 % і зменшувалась в 1,2 рази у порівнянні з
попередньою експериментальною групою та в 1,1 рази відносно контролю (рис. 1).
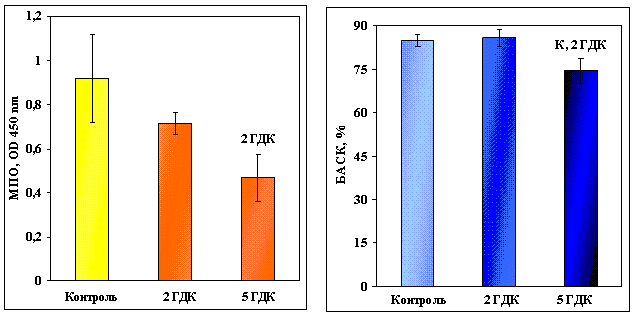
Рис. 1. Активність
мієлопероксидази та бактерицидна активність сироватки крові Cyprinus carpio L. у
контролі та за умов дії біхромату калію. Концентрація Cr6+ 1 мг/л (2 ГДК) та 2,5 мг/л (5 ГДК). Дані представлені як середнє ± його
похибка (n=7-8). Надписи над стовпчиками означають
вірогідну відмінність з вказаною групою, Р < 0,005.
Титр гетерофільних антитіл за
умов дії обох концентрацій іонів шестивалентного хрому зменшився вдвічі
відносно контролю. Разом з тим, концентрації С-реактивного білку, фібриногену в
сироватці крові не змінились у порівнянні з контролем (табл. 1).
Таблиця 1. Концентрація фібриногену, С-реактивного білку та
титр гетерофільних антитіл в сироватці крові Cyprinus carpio L. у контролі та за умов дії біхромату калію.
|
Показник |
Контроль |
2 ГДК |
5 ГДК |
|
Титр гетерофільних антитіл |
1 : 8 |
1 : 4 |
1 : 4 |
|
Фібриноген, г/л |
2,75 ± 0,38 |
2,64 ± 0,27 |
2,02 ± 0,44 |
|
С-реактивний білок, мг/л |
1,80 ± 0,30 |
1,50 ± 0,47 |
1,25 ± 0,46 |
З отриманих результатів можна
зробити висновок, що активність мієлопероксидази, бактерицидна активність
сироватки крові та титр гетерофільних антитіл можуть виступати біомаркерами
імунотоксичності хрому (VI).
Література:
1.
Давидов О.Н,
Темниханов Ю.Д., Куровская Л.Я. Патология крови рыб. – Фирма “ИНКОС”,
2006. – 206 с.
2. Заботкина Е.А., Лапирова Т.Б. Влияние тяжелых металлов на иммунофизиологический статус рыб. – Успехи соврем. биологии. – 2003. – Т. 123, №4. – с. 401-408.
3.
Селиверстов
В.В. Методические указания по проведению гематологического обследования рыб. –
Москва. – 1999 – 38 с.
4.
Dam
W., Nussey M., Vuren JHJ., Preez HH. Bioaccumulation of chromium, manganese,
nickel and lead in the tissues of the moggel, Lambeo umbratus (Cyprinidae)
// Water SA. – 2000. – Vol. 26, № 2. – P.
269-286.
5.
Driver
C.J. Ecotoxicity literature review of selected hanford site contaminants //
USA. – 1994. – 132p.
6. Mohanty R.B., Sahoo P.K.,
Mahapatra K.D., Saha J.N. Innate immune response in families of Indian major
carp, Labeo rohita, differening in
their resistance to Edwardsiella tarda infection
// Current Science. – 2007. – Vol. 92, № 9. – P. 1270-1274.
7.
Paul
I., Mandal C., Mandal C. Effect of environmental pollutants on the С-reactive protein of a freshwater major carp, Catla catla // Developmental & Comparative Immunology. – 1998.
– Vol. 22, № 5-6. – P. 519-532.