УДК 533.27
Температурный эффект смешения
газов
Павлов А. М, Троеглазова Т. В.
Восточно-Казахстанский государственный университет имени С. Аманжолова,
г. Усть- Каменногорск .Казахстан (070010 Севастопольская 7/1,30) ampavlov@mail.ru
Выведена и проанализирована формула для расчета температурного эффекта
смешения газов. Расчетная формула проверена в результате теоретического расчета
на примере смесей газов: ![]() ,
, ![]() ,
, ![]() . Полученное уравнение позволило удовлетворительно описать
экспериментальные данные по температурному эффекту смешения газов.
. Полученное уравнение позволило удовлетворительно описать
экспериментальные данные по температурному эффекту смешения газов.
Ключевые слова: температурный эффект, комплексы молекул, кластер,
концентрация.
Introduce and analyze the formula for calculating
the temperature effect of gas mixing. The calculation formula is tested by a
theoretical calculation on the
example of mixtures of gases: ![]() The resulting equation is allowed
to satisfactorily describe
experimental data on the thermal effect of mixing gases.
The resulting equation is allowed
to satisfactorily describe
experimental data on the thermal effect of mixing gases.
Key words: temperature effect,
complex molecules, clusters, concentration.
Когда говорят
о температурном эффекте смешения газов, то имеют ввиду изменение температуры
смеси при ![]() . Этот эффект практически не упоминается в публикациях. Нам
известна лишь одна работа И. Г. Шамсутдинова, который пытался экспериментально
изучить этот эффект. В [1] лишь упоминается об измерении температурного
изохорно-адиабатического эффекта смешения
. Этот эффект практически не упоминается в публикациях. Нам
известна лишь одна работа И. Г. Шамсутдинова, который пытался экспериментально
изучить этот эффект. В [1] лишь упоминается об измерении температурного
изохорно-адиабатического эффекта смешения ![]() системы
аргон-двуокись углерода при температуре
системы
аргон-двуокись углерода при температуре ![]() и различных
давлениях. Никаких числовых значений не приведено. Сказано лишь, что эффект
может достигать 11%. Далее автор говорит о большой погрешности опытов (около
10%) и необходимости дальнейших исследований.
и различных
давлениях. Никаких числовых значений не приведено. Сказано лишь, что эффект
может достигать 11%. Далее автор говорит о большой погрешности опытов (около
10%) и необходимости дальнейших исследований.
В книге Павлова А. М. «Комплексы молекул и их влияние на свойства газов»[2] выведены для них формулы, но сравнение с экспериментальными данными проводилось недостаточно.
В данной статье восполняется этот пробел.
Сложность
опытов по измерению ![]() при смешивании газов
вполне понятна. С одной стороны газы должны быть смешаны очень быстро, чтобы
температура не успела измениться вследствие теплопроводности стенок. С другой
стороны для полного перемешивания газов нужно время. Видимо по этой причине, не
считая свои данные убедительными, автор их не приводит [2].
при смешивании газов
вполне понятна. С одной стороны газы должны быть смешаны очень быстро, чтобы
температура не успела измениться вследствие теплопроводности стенок. С другой
стороны для полного перемешивания газов нужно время. Видимо по этой причине, не
считая свои данные убедительными, автор их не приводит [2].
Попробуем осветить
это явление теоретически. Первый газ из объема ![]() , расширяется до объема
, расширяется до объема ![]() , а второй газ от объема
, а второй газ от объема ![]() , до
, до ![]() . Получается, что каждый газ совершает работу по расширению
до соответствующего объема. Кроме этого, как выше было показано, меняется
концентрация комплексов молекул, комплексы распадаются за счет кинетической
энергии молекул. Эти две причины и должны приводить к понижению температуры
смеси.
. Получается, что каждый газ совершает работу по расширению
до соответствующего объема. Кроме этого, как выше было показано, меняется
концентрация комплексов молекул, комплексы распадаются за счет кинетической
энергии молекул. Эти две причины и должны приводить к понижению температуры
смеси.
В случае
адиабатического расширения газа сохраняется энтальпия. Следовательно
![]()
или
![]() ,
(1)
,
(1)
где ![]() - давление смеси сразу
после смешивания при температуре Т.
Отсюда видно, что для определения
- давление смеси сразу
после смешивания при температуре Т.
Отсюда видно, что для определения ![]() необходимо записать
внутреннюю энергию газов до и после смешивания. Кроме этого, следует определить
необходимо записать
внутреннюю энергию газов до и после смешивания. Кроме этого, следует определить
![]() , которое не равно барическому эффекту смешения, так как
температура не равна
, которое не равно барическому эффекту смешения, так как
температура не равна ![]() .
.
Как
было показано выше, внутренняя энергия газа, если ![]() , равна:
, равна:
![]() , (2)
, (2)
где ![]() .
.
Чтобы записать внутреннюю энергию
смеси, необходимо пользоваться выражением для F смеси.
Поскольку второй вириальный коэффициент чистого газа равен В мономера, в ![]() должны стоять В мономеров и концентрации компонентов,
а не кластеров. Далее вместо
должны стоять В мономеров и концентрации компонентов,
а не кластеров. Далее вместо ![]() будет
будет ![]() , где буквами «А» и
«В» будем обозначать компоненты.
Таким образом,
, где буквами «А» и
«В» будем обозначать компоненты.
Таким образом,
![]() ,
(3)
,
(3)
где ![]() .
.
Запишем
внутреннюю энергию аргона и углекислого газа, а так же их смеси; поскольку у
этой смеси есть хоть какие-то экспериментальные данные по температурному
эффекту смешения [1].
У аргона критическая
температура 150К, а у углекислого
газа 304К. Таким образом, при ![]() аргон находится при
температуре выше критической, степень его кластеризации мала и для
аргон находится при
температуре выше критической, степень его кластеризации мала и для ![]() , следует воспользоваться следующей формулой:
, следует воспользоваться следующей формулой:
![]() . (4)
. (4)
Углекислый газ
при ![]() становится насыщенным
паром при
становится насыщенным
паром при ![]() , то есть
, то есть ![]() . В [1] опыты по барическому эффекту проводились при
давлениях от 1 до
. В [1] опыты по барическому эффекту проводились при
давлениях от 1 до ![]() . Тем не менее, для СО2
будем брать внутреннюю энергию в виде, написанном выше, пренебрегая х2, поскольку он всё таки
далек от критического состояния.
. Тем не менее, для СО2
будем брать внутреннюю энергию в виде, написанном выше, пренебрегая х2, поскольку он всё таки
далек от критического состояния.
У однородных молекул наблюдается резонансное взаимодействие, вследствие которого энергия притяжения становится на порядок выше энергии обычного вандерваальсова взаимодействия. В связи с этим, будем учитывать лишь комплексы из однородных молекул. В этом приближении внутреннюю энергию смеси можно записать в следующем виде:
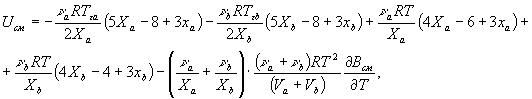 (5)
(5)
где ![]() , а
, а ![]() и
и ![]() - глубина
потенциальной ямы в потенциале Леннарда – Джонса и она отрицательная.
- глубина
потенциальной ямы в потенциале Леннарда – Джонса и она отрицательная.
Выше
говорилось, что для нахождения ![]() необходимо найти
разность
необходимо найти
разность
![]() .
.
Подставим сюда ![]() :
:
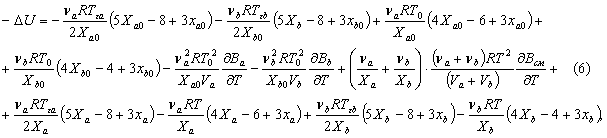
В этой формуле Ха и Хb относятся к температуре Т, которая будет в смеси сразу после смешения газов, Ха0 и Хb0 относятся к начальной температуре Т0.
В работе [2] показано, что
 . (7)
. (7)
Эти равенства были получены в
случае смешивания газов при постоянной температуре, то есть при Т=Т0. Вообще говоря,
поскольку ![]() и
и ![]() при том же объеме.
Однако, учитывая малость изменения температуры, можно пренебречь изменением
при том же объеме.
Однако, учитывая малость изменения температуры, можно пренебречь изменением ![]() вследствие наличия
вследствие наличия ![]() . В самом деле, так как
. В самом деле, так как
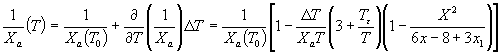 ,
,
то слагаемым, содержащим ![]() можно пренебречь по
сравнению с единицей. Поэтому будем считать
можно пренебречь по
сравнению с единицей. Поэтому будем считать ![]() и
и ![]() , то есть предполагается, что концентрация комплексов
меняется лишь вследствие расширения газа.
, то есть предполагается, что концентрация комплексов
меняется лишь вследствие расширения газа.
Заменим
Т через ![]() и
и ![]() через
через ![]() ,
, ![]() через
через ![]() используя (7):
используя (7):
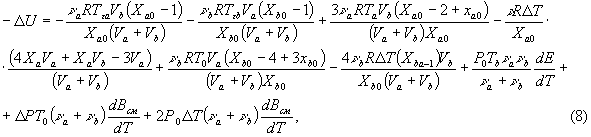
где ![]() .
.
Выше
было записано, что ![]() . Преобразуем далее
. Преобразуем далее ![]() . Так как при барическом эффекте смешения давление
замерялось, то можно привести давление смеси
. Так как при барическом эффекте смешения давление
замерялось, то можно привести давление смеси ![]() при температуре Т к давлению Р при температуре
при температуре Т к давлению Р при температуре ![]() :
:
![]() .
.
Тогда, получим:
 . (9)
. (9)
Приравнивая это выражение к ![]() и вводя
и вводя ![]() вместо
вместо ![]() , получим формулу для
, получим формулу для ![]() . Необходимо еще отметить, что если Х искать по PVT – данным, то в уравнении
состояния
. Необходимо еще отметить, что если Х искать по PVT – данным, то в уравнении
состояния ![]() можно считать, что
круглая скобка входит в Х и записать его в виде
можно считать, что
круглая скобка входит в Х и записать его в виде ![]() .
.
После не сложных преобразований получим:

где ![]() .
(10)
.
(10)
При получении этого выражения слагаемые, содержащие вириальные коэффициенты, не учитывались.
Определив по РVТ данным ![]() и
и ![]() , а так же
, а так же ![]() и
и ![]() , подставим в полученное нами выражение и учтем, что в опытах
[1] было
, подставим в полученное нами выражение и учтем, что в опытах
[1] было ![]() и
и ![]() . Тогда получим:
. Тогда получим: ![]() , что находится в удовлетворительном согласии с опытом. И. Г
Шамсутдинов приводит лишь максимальное изменение
температуры в 11%, не указывая давления при котором оно получено. Возможно, что
учет
, что находится в удовлетворительном согласии с опытом. И. Г
Шамсутдинов приводит лишь максимальное изменение
температуры в 11%, не указывая давления при котором оно получено. Возможно, что
учет ![]() , где
, где ![]() и
и ![]() даст лучшие
результаты.
даст лучшие
результаты.
Сравнить
![]() с экспериментом
невозможно, поскольку опытных данных по температурному эффекту смешения просто
нет. Давление в 5,5МПа при Т=293К является для
с экспериментом
невозможно, поскольку опытных данных по температурному эффекту смешения просто
нет. Давление в 5,5МПа при Т=293К является для ![]() областью насыщенного
пара и жидкости. Поэтому в этой точке плотность в справочнике Н.Б. Варгафтика
отсутствует.
областью насыщенного
пара и жидкости. Поэтому в этой точке плотность в справочнике Н.Б. Варгафтика
отсутствует.
Данные
таблицы 5 из [1] показывают, что максимальный барический эффект смешения будет
при ![]()
![]() . Хотя в нашей формуле
. Хотя в нашей формуле ![]() и
и ![]() входят не совсем
симметрично, следует ожидать, что и температурный эффект будет максимален при
этой же объемной концентрации. Ниже в таблице 1 приведены значения
входят не совсем
симметрично, следует ожидать, что и температурный эффект будет максимален при
этой же объемной концентрации. Ниже в таблице 1 приведены значения ![]() , подсчитанные по полученной формуле.
, подсчитанные по полученной формуле.
Таблица 1 – Значения температурного эффекта смешения некоторых газов
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
270 |
1 |
0,0080905 |
-0,00781 |
0,074037 |
-0,00275 |
0,0197 |
-0,0056 |
|
2 |
0,017382 |
-0,01643 |
0,020635 |
-0,01798 |
0,0436 |
-0,01906 |
|
|
3 |
0,039068 |
-0,0511 |
|
|
0,0815 |
-0,0576 |
|
|
290 |
1 |
0,006231 |
-0,00563 |
0,004704 |
-0,00173 |
0,017 |
-0,00625 |
|
2 |
0,009583 |
-0,00365 |
0,012298 |
-0,00969 |
0,037 |
-0,017 |
|
|
3 |
0,0206622 |
-0,01978 |
|
|
0,0607 |
-0,03484 |
|
|
4 |
0,040143 |
-0,04749 |
0,03998 |
-0,04482 |
0,0896 |
-0,05984 |
|
|
300 |
1 |
0,005309 |
-0,00494 |
|
|
0,015 |
-0,00646 |
|
2 |
0,011527 |
-0,01154 |
0,011421 |
-0,01047 |
0,0321 |
-0,01475 |
|
|
3 |
0,018606 |
-0,01958 |
|
|
|
|
|
|
4 |
0,027302 |
-0,02957 |
0,027208 |
-0,0269 |
0,071 |
-0,039 |
|
|
5 |
0,039686 |
-0,04601 |
|
|
|
|
|
|
6 |
0,062572 |
-0,07536 |
0,063263 |
-0,07009 |
0,136 |
-0,099 |
|
СПИСОК ЛИТЕРАТУРЫ
1 Павлов А. М. Комплексы молекул и их влияние на свойства газов. Издательство ВКГУ им. С. Аманжолова – Усть–Каменогорск, 2010. – 282с.
2 Шамсутдинов И.Г. Исследование зффектов смешения некоторых газов при различных давлениях и температурах до линии насыщения одного из компонентов.
Автореферат диссертации на соискание уч.степ. кандидата физ.мат.наук.Алма-Ата 1982