Квач С.В., Ерошевская Л.А., Зинченко А.И.
Институт микробиологии НАН Беларуси, Минск
получение
препарата иммобилизованной бактериальной нуклеозидфосфотрансферазы
Нуклеозидфосфотрансфераза
(ФК 2.7.1.77; НФТ) представляет собой фермент, катализирующий перенос низкоэнергетических
фосфатных групп с молекул НМФ,
п-нитрофенилфосфата (пНФФ), фенилфосфата и др. на гидроксил пентозного
фрагмента нуклеозида [1–3]. Пример биотрансформации нуклеозида (аденозина) в
НМФ, катализируемой НФТ, приведен на схеме.

Ранее мы сконструировали рекомбинантные
штаммы E. coli NPT5 и E. coli НФТ-15, продуцирующие НФТ Erwinia herdicola, разработали методы выделения
и очистки этого фермента и продемонстрировали возможность его использования для
синтеза природных и модифицированных НМФ [4, 5].
Цель настоящей работы заключалась в
получении катализатора, проявляющего нуклеозидфосфотрансферазную активность, для
многократного использования при синтезе НМФ.
Материалы
и методы. Конструирование и
культивирование рекомбинантных штаммов E.
coli, продуцирующих НФТ Erwinia
herdicola, а также выделение и очистка этого фермента описаны нами ранее [4,
5].
Нуклеозидфосфотрансферазную активность
определяли по скорости синтеза АМФ из аденозина при использовании в качестве
донора фосфата пНФФ. За единицу активности принимали такое количество фермента,
которое обеспечивало образование АМФ в количестве 1 нмоль за 1 мин.
Иммобилизацию проводили на активированный
последовательно 3-[2-(2-аминоэтиламино)этиламино]пропил-триметоксисиланом и
глутаровым альдегидом SiO2 [6] (далее активированный силикагель). К 1 г
активированного силикагеля приливали 20 мл раствора фермента (900 000 ед.
активности) в 0,1 М Na-ацетатном или К-фофатном буфере
(КФБ), инкубировали 3 ч при комнатной температуре. После декантирования раствора
носитель промывали 4 раза по 100 мл 0,1 М Na-ацетатного буфера (рН 4,5). Осадок высушивали на фильтровальной
бумаге при комнатной температуре в течение 12 ч.
Синтез АМФ иммобилизованной НФТ проводили, инкубируя смесь
(2 мл), содержащую 30 мМ аденозин, 60 мМ пНФФ, 0,2 М Na-ацетатный буфер (рН 4,5) и ферментный
препарат (40 ед.), 5 ч при 45oC.
Результаты и обсуждение. Нами в
качестве метода иммобилизации была выбрана ковалентная пришивка фермента с
помощью глутарового альдегида на предварительно активированный
3-[2-(2-аминоэтил-амино)этиламино]пропил-триметоксисиланом силикагель.
3-[2-(2-аминоэтиламино)этиламино]пропил-триметоксисилан – соединение,
дающее при конденсации на силикагеле с помощтю “sol-gel”-метода
аминированную поверхность. Глутаровый альдегид; наиболее широко используемый
сшивающий агент для ковалентной иммобилизации ферментов. Применение данного
реагента основано на образовании в слабощелочной среде азометиновой связи
оснований Шиффа (-СН=N-) в реакции альдегида с аминогруппами носителя. Вторая
альдегидная группа образует такое же основание со свободными аминогруппами в
пришиваемом белке.
На первом этапе нами была изучена эффективность иммобилизации НФТ от рН
среды. В качестве буферов использовали 20 мМ Na-ацетатный буфер (рН 4–6),
и 20 мМ КФБ (рН 6–8). Результаты представлены в таблице.
Таблица
Влияние рН на
иммобилизацию НФТ
|
рН |
Белок, связавшийся с
матрицей, % от исходного количества |
Активность НФТ, % от исходного
количества |
Активность
иммобилизованной НФТ, ед/мг препарата |
|
4 |
70 |
23 |
173 |
|
4,5 |
80 |
27 |
198 |
|
5 |
75 |
25 |
183 |
|
5,5 |
60 |
18 |
132 |
|
6 |
45 |
11 |
81 |
|
7 |
30 |
5 |
37 |
Как видно из представленных
данных, наиболее эффективно иммобили-зация НФТ проходит при рН 4,5
(присоединяется к матрице 80% белка с сохра-нением 27% исходной активности). На следующем этапе работы были
изучена операционная стабильность иммобилизованного фермента.
Для исследования стабильности НФТ проводили реакцию
синтеза АМФ из аденозина и пНФФ. По окончании синтеза биокатализатор отбирали
центрифугированием и вносили в новую реакционную смесь. Результаты этого эксперимента
представлены на рисунке.
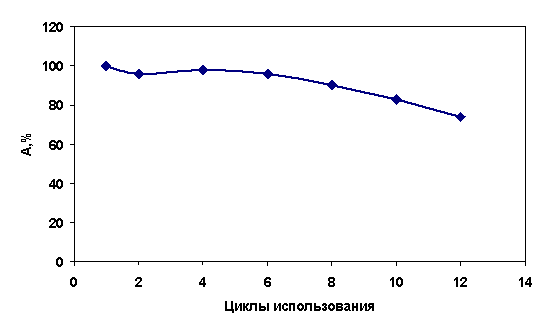
Рисунок – Операционная стабильность
иммобилизованной НФТ
А – активность препарата в % от исходной
Как видно из рисунка, иммобилизованная НФТ
сохраняет до 90% своей активности при использовании в течение 8 циклов. Далее,
активность начинает снижаться до 60% к 14 циклу использования.
Для исследования
стабильности препарата иммобилизованной НФТ при хранении его ресуспендировали в
50 мМ Трис–HCl-буфере (pH 7,0), содержащем 10% глицерина, и помещали на холод (+4°С).
В описанных экспериментальных условиях полученный ферментный
препарат сохраняет свою активность при хранении в течение минимум 2 мес.
Литература:
1. Humble, R.W.
Phosphorylation of some 5-aminoimidazole nucleosides to the 5'-phosphates using
a phosphotransferase from wheat / R.W. Humble, G. Mackenzie, G. Shaw // Nucleosides,
Nucleotides.– 1984.– Vol. 3, № 4.– Р. 363–367.
2. Rutkowski,
M. Phosphorylation of acyclonucleosides by nucleoside phosphotransferase from
higher plants and bacteria / M. Rutkowski, M. Draminski // Acta Biochim. Pol.– 1991.– Vol. 38, № 4.– P. 449–457.
3. Chemical-enzymatic
synthesis of 3'-amino-2',3'-dideoxy-b-D-ribofurano-sides
of natural heterocyclic bases and their 5'-monophosphates / G.V. Zaitseva [et
al.] // Collect. Chech. Chem. Commun. – 1993.
– Vol. 58. – P. 60–63.
4. Use
of Erwinia herbicola recombinant nucleoside phosphotransferase for the
synthesis of pharmaceutically useful nucleoside-5′-monophosphates / S.V.
Kvach [et al.] // New Aspects of Biotechnology and Medicine / Eds. A.M.Egorov
and G.E.Zaikov. – NY: Nova Science Publishers, Inc. – 2007. – P. 7–13.
5. Штамм бактерии Escherichia coli, продуцирующий нуклеозидфосфотрансферазу Erwinia herdicola: пат. 11916 Респ. Беларусь / С.В. Квач, Л.А. Ерошевская, А.И.
Зинченко; заявл. 01.10.07; опубл. 30.06.09.
6.
Guisan, J.M. Immobilization of Enzymes and Cells / J.M. Guisan. – 2-nd ed. – Totowa,
New Jersey: Humana Press Inc., 2006. –449 p.
