Батушанский
А.М., Дубовик Л.В., Квач С.В., Ерошевская Л.А.,
Зинченко
А.И.
Институт
микробиологии НАН Беларуси, Минск
СОЗДАНИЕ НУКЛЕАЗОУСТОЙЧИВЫХ ДНК-СОДЕРЖАЩИХ СТРУКТУР
Известно, что бактериальная ДНК содержит
т.н. «CpG-мотивы» – особые шестичленные последовательности нуклеотидов, в
центре которых расположен СpG-динуклеотид. При введении в организм позвоночных
таких CpG-мотивов, например, в виде бактериальной ДНК или химически
синтезированных олигодезоксинуклеотидов, они действуют как сигнал опасности для
клеток иммунной системы и активируют не только врожденную систему
неспецифической защиты от патогенов, но и приводят к активации приобретенного
иммунного ответа [1, 2].
В ряде работ описана эффективность
геномной и плазмидной бактериальной ДНК в качестве адъювантов, усиливающих
действие различных вакцин в лечении аллергических реакций и вирусных
заболеваний, а также злокачественных новообразований [3, 4].
На сегодняшний день не решена проблема
эффективной доставки бактериальной ДНК в клетки млекопитающих. Так как
свободная бактериальная ДНК подвергается атаке нуклеаз, эффект от ее введения в
организм млекопитающих низок. В настоящее время разрабатываются методы доставки
ДНК в клетку с помощью липосом, а также в качестве комплексов с различными
неорганическими носителями [5, 6].
Целью данной работы являлось создание
нуклеазоустойчивых ДНК-карбонатапатитных комплексов [7] для рН-зависимого
внутриклеточного высвобождения нуклеиновой кислоты.
Материалы
и методы. В работе использовалась
геномная ДНК, выделенная из штамма E. coli
DH5α. Наработка нуклеиновой кислоты осуществлялась
по стандартной методике [5]. В результате было выделено 2 мг геномной ДНК со
следующими характеристиками: Е260:Е280=1,8; Е260:Е230=2,2.
Препарат ДНК растворяли в ТЕ-буфере (рН
7,5) до концентрации 0,6 мг/мл и хранили при -20ºС.
Для получения нуклеазоустойчивых структур
5 мкл раствора геномной ДНК (0,6 мг/мл) добавляли к помещенным в пластиковую
пробирку 40 мкл 1 М CaCl2 и аккуратно перемешивали, после чего в пробирку
добавляли 500 мкл раствора I (рН 7,5),
содержащего 80 мМ NaHCO3 и 9 мМ NaH2PO4. Затем
пробирку помещали в термостат на 37ºС и инкубировали 30 мин, по истечении
которых смесь центрифугировали 10 мин при 10000 g.
Контроль связывания ДНК и неорганических
ионов, а также проверка устойчивости образованного комплекса к ДНКазе I из поджелудочной железы быка (Serva, Германия) проводили с помощью электрофореза в
агарозном геле.
Полученный комплекс проверяли на
стабильность путем повторного электрофоретического исследования спустя 24 час после
его образования. Устойчивость комплекса при нейтральных pH и возможность его распада при кислых pH также проверяли с помощью гель-электрофореза.
Контроль за возможной агрегацией частиц
осуществляли измерением поглощения раствором света с длинной волны 320 нм [7].
Результаты
и обсуждение. В ходе получасового
инкубирования смеси, содержащей геномную ДНК, CaCl2, NaHCO3 и NaH2PO4, предполагаемое формирование нуклеазоустойчивых
ДНК-содержащих частиц происходило по схеме, представленной на рис. 1.
В процессе нагревания, происходит замена
атомов хлора в молекулах CaCl2 на карбонатные группы с одновременным связыванием
отрицательно заряженных молекул ДНК с несущими положительный заряд ионами Ca2+. В
результате образуются сферические структуры (предположительно наноразмеров
[7]), в которых ДНК располагается внутри частиц. Такая локализация ДНК защищает
ее от действия нуклеаз (рис. 2).
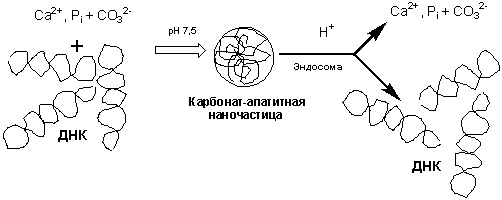
Рис. 1.
Предполагаемая схема образования и диссоциации ДНК-содержащих наночастиц

Рис. 2. Электрофоретический анализ инкубационной смеси
после формирования в ней ДНК-карбонатапатитных комплексов.
1 – Свободная ДНК; 2 – супернатант, полученный после центрифугирования
реакционной смеси при 10 тыс. g 10 мин; 3 – осадок ДНК-карбонатапатитных частиц (0,05 мкг ДНК);
4 – свободная ДНК (0,05 мкг) после 10 мин инкубирования с ДНКазой (360 ед); 5 –
ДНК-карбонатапатитные частицы (0,05 мкг ДНК) после 10 мин инкубирования с
ДНКазой (360 ед).
Образованные частицы проявляют
стабильность при нейтральных значениях рН среды, но высвобождать ДНК в кислых
условиях (рис. 3).

Рис. 3. Электрофоретический анализ рН-стабильности
ДНК-карбонатапатитного комплекса.
1 – ДНК (0,05 мкг); 2 –
супернатант, полученный после центрифугирования ДНК-карбонатапатитного
комплекса (0,05 мкг ДНК), ресуспендированного в 0,1 М К-фосфатном буфере (рН
7,0; 24 ч); 3 – супернатант, полученный после центрифугирования
ДНК-карбонатапатитного комплекса (0,05 мкг ДНК), ресуспендированного в 0,01 М HCl (рН 2,5; 5 мин).
Полученные ДНК-содержащие
частицы не агрегируют между собой, что было показано методом спектрофотометрии
при длине волны 320 нм (табл. 1).
Таблица 1 –
Изменение оптической плотности раствора кальций-карбонатных наночастиц с
течением времени при длине волны 320 нм
|
Продолжительность инкубирования, мин |
Оптическая плотность |
|
0 |
2,635 |
|
15 |
2,638 |
|
30 |
2,636 |
Таким образом, в настоящей работе были
получены ДНК-карбонатапатитные комплексы, которые возможно использовать для
доставки в клетки млекопитающих богатой CpG-мотивами геномной бактериальной ДНК. Показана
устойчивость полученных комплексов к действию ДНКазы, стабильность при хранении
в среде с нейтральными значениями рН и способность к диссоциации в кислой
среде.
Литература:
1. Krieg A.M. Antiinfective application of Toll-like receptor 9 agonists // Proc.
Am. Thorac. Soc. 2007. Vol. 4. P. 289–294.
2. Lanzavecchia A., Sallusto F. Toll-like receptors and innate immunity
in B-cell activation and antibody responses // Curr. Opin. Immunol. 2007. Vol.
19. P. 268–274.
3.
Kojima Y., Xin K., Ooki T. et al. Adjuvant effect of multi-CpG motifs
on an HIV-1 DNA vaccine // Vaccine. 2002. Vol. 20. P. 2857–2865.
4. Schneeberger A., Wagner C., Zemann A. et al. CpG motifs are efficient
adjuvants for DNA cancer vaccines // J. Invest. Dermatol. 2004. V. 123. P. 371–379.
5. Wilson K., Raney S.G., Sekirov L. et al. Effects of intravenous and
subcutaneous administration on the pharmacokinetics, biodistribution, cellular
uptake and immunostimulatory action of CpG ODN encapsulated in liposomal
nanoparticles // Int. Immunopharm. 2007. Vol. 7. P. 1064–1075.
6. Xu Z.P., Zeng Q.H., Lu G.Q., Yu A.B. Inorganic nanoparticles as
carriers for efficient cellular delivery // Chem. Eng. Sci. 2006. Vol. 61. P.
1027–1040.
7. Chowdhury E.H., Maruyama A., Kano A. et al. pH-sensing nano-crystals
of carbonate apatite: Effects on intracellular delivery and release of DNA for
efficient expression into mammalian cells // Gene. 2006. Vol. 376, N 1. P.
87–94.
8. Sambrook J., Frittsch E., Maniatis T. Molecular Cloning: a Laboratory
Manual. – 2-nd ed. – New York: Cold Spring Harbor Laboratory Press, 1989.