Квач С.В.1,
Ерошевская Л.А.1, Шахбазов А.В.2, Картель Н.А.2,
Зинченко А.И.1
1Институт микробиологии НАН Беларуси,
Минск
2Институт генетики и цитологии НАН Беларуси, Минск
ПОЛУЧЕНИЕ И ОПТИМИЗАЦИЯ УСЛОВИЙ ЭКСПРЕССИИ штамма-суперпродуцента тимидинфосфорилазы Escherichia coli
Модифицированные
нуклеозиды нашли широкое применение в биохимических и молекулярно-биологических
исследованиях. Однако наиболее важной областью их применения является медицина.
Так, на основе модифицированных нуклеозидов уже создан целый ряд
высокоэффективных противовирусных (ацикловир, виразол, видарабин, азидотимидин
и др.) и противоопухолевых (кладрибин, флударабин, гемцитабин, цитазар и др.)
лекарственных препаратов и постоянно ведется целенаправленный поиск новых
высокоактивных нуклеозидов [1,2].
Оптимальными
биокатализаторами при получении модифицированных нуклеозидов являются ферменты
– нуклеозидфосфорилазы (КФ 2.4.2.3). Нуклеозидфосфорилазы Escherichia coli
представлены тремя ферментами: уридинфосфорилазой, тимидинфосфорилазой (ТФазой),
использующими в качестве субстратов пиримидиновые нуклеозиды, и
пуриннуклеозидфосфорилазой, субстратами которой являются пуриновые нуклеозиды.
Целью данной
работы было повышение уровня экспрессии ТФазы
E. сoli – фермента,
катализирующего обратимый фосфоролиз тимидина и широкого ряда его
модифицированных аналогов, путем клонирования гена tpp в составе плазмиды pET24b+ в
клетках E. coli.
Объекты и методы исследования. Ген tpp, кодирующий ТФазу, был выделен методом ПЦР с
использованием в качестве матрицы геномной ДНК штамма E. coli
БМТ-4Д/1А [1]. Для амплификации гена tpp
использовали следующую пару праймеров: «прямой» – (5'-GGAATTCATATGTTGTTTCTCGCACAA-3') и «обратный» – (5'-TTTTGTCGACTTATTCGCTGATACGG-3'). В 5'-конец прямого праймера был встроен сайт рестрикции эндонуклеазы NdeI, а
в обратный праймер – сайт узнавания рестриктазы
SalI
(выделены жирным шрифтом). Для проведения реакции амплификации использовали 1
ед. активности Fusion HF-полимеразы (New England
Biolab, США). Синтезированный с помощью ПЦР продукт выделяли из
геля, используя набор реактивов «Wizard SV
gel and PCR
clean-up system»
(Promega, США), согласно методике фирмы-изготовителя, обрабатывали смесью рестриктаз NdeI и SalI и
полученную вставку с геном tpp
лигировали в вектор pET24b+, содержащий T7-промотор
(Novagen, США). В результате была сконструирована
плазмида pETtdp, несущая ген tpp.
Этим вектором были трансформированы клетки E. coli BL21(DE3)
с получением нового штамма, обозначенного E.
coli TDP.
Клетки E. coli TDP выращивали на LB-среде, содержащей 50
мкг/мл канамицина, до оптической плотности 0,6 (λ = 600 нм); затем
проводили индукцию синтеза белка путем внесения изопропил-β-D-тиогалактопиранозида
(IPTG) до концентрации 0,2, 0,4 и 1,0 мМ и продолжали
культивирование в течение 5 ч. При использовании в качестве индуктора α-D-лактозы,
ее вносили в среду для культивирования вместо IPTG в концентрациях 0,2%,
0,4% и 1%.
В процессе
культивирования отбирались аликвоты культуры (1 мл), клетки осаждали
центрифугированием в течение 10 мин при 5000 × g. Полученный в
результате центрифугирования осадок клеток
ресуспендировали в 10 мМ калий-фосфатном буфере (рН 7,5).
Активность
ТФазы определяли спектрофотометрически по изменению поглощения при фосфоролизе
тимидина (λ=300 нм) [3].
За единицу
активности ТФазы принимали такое её количество, которое обеспечивало
образование 1 мкмоль продукта за 1 мин в условиях проведения реакции.
Результаты и их обсуждение. Ген tpp, кодирующий ТФазу
E. coli был изолирован с использованием ПЦР с применением высокоточной
Fusion HF-полимеразы и встроен в плазмиду pET24b+ вниз от Т7 промотора. Индукция
экспрессии белка в данной конструкции обеспечивается добавлением в среду IPTG.
 Как известно из
литературных данных, оптимальная концентрация IPTG для максимальной
индукции синтеза белка в pET-системе может
варьироваться в широких пределах (0,2–1,0 мМ) [4]. Оптимальная концентрация
зависит как от используемого вектора и штамма реципиента, так и от токсичности
экспрессирующегося белка. В общем случае она подбирается эмпирически
экспериментальным путем. Для используемого нами вектора pET24b+ в
качестве начальной рекомендуется 1,0 мМ концентрация IPTG [4]. Поскольку данное
соединение является достаточно дорогостоящим, нами было проведено изучение
влияние его концентрации на эффективность экспрессии ТФазы. Результаты
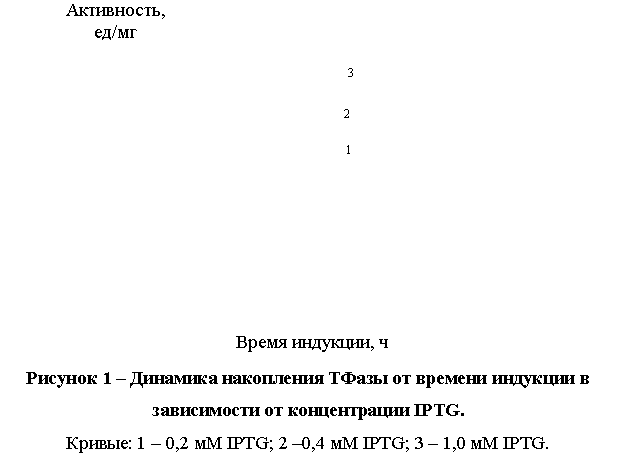
эксперимента приведены на рисунке 1.
Как известно из
литературных данных, оптимальная концентрация IPTG для максимальной
индукции синтеза белка в pET-системе может
варьироваться в широких пределах (0,2–1,0 мМ) [4]. Оптимальная концентрация
зависит как от используемого вектора и штамма реципиента, так и от токсичности
экспрессирующегося белка. В общем случае она подбирается эмпирически
экспериментальным путем. Для используемого нами вектора pET24b+ в
качестве начальной рекомендуется 1,0 мМ концентрация IPTG [4]. Поскольку данное
соединение является достаточно дорогостоящим, нами было проведено изучение
влияние его концентрации на эффективность экспрессии ТФазы. Результаты
эксперимента приведены на рисунке 1.
Из
рисунка 1 видно, что увеличение концентрации IPTG приводит к заметному увеличению продукции ТФазы. Максимальная
активность ТФазы (61 ед/мг) достигается при индукции с помощью 1,0 мМ IPTG. Также видно, что максимальная активность при
индукции любой концентрацией IPTG достигается
через 4 ч, а затем резко падает.
Данные
по максимальной активности, отнесенной на мг сухой клеточной биомассы, и по
выходу ТФазы с единицы объема культуральной среды приведены в табл. 1.
Таблица 1 – Продуцирование
ТФазы E. coli
TDP в зависимости от концентрации IPTG в питательной среде
|
Концентрация
IPTG, мМ |
Биомасса, мг/мл |
Максимальная
активность ТФазы |
|
|
ед/мг |
ед/мл |
||
|
1,0 |
1,18 |
61,0 |
72,0 |
|
0,4 |
1,32 |
54,0 |
71,3 |
|
0,2 |
1,32 |
48,3 |
63,8 |
Из
данных табл. 1 видно, что максимальный выход фермента (72 ед/мл) достигается
при индукции с помощью 1,0 мМ IPTG. Тем не
менее, при индукции 0,4 мМ IPTG этот
показатель (71,3 ед/мл) лишь немного уступает таковому, достигаемому при
индукции 1,0 мМ IPTG, в то время
как количество дорогостоящего индуктора снижается в 2,5 раза.
На следующем этапе была изучена возможность экспрессии ТФазы
с использованием в качестве индуктора не только обычно применяемого в таких
случаях известного аналога лактозы – IPTG, но также и самой
лактозы, которая является более дешевым соединением, что играет немаловажную
роль при получении белка в препаративных количествах.
В настоящем исследовании для проверки возможности использования
лактозы в качестве индуктора экспрессии ТФазы ее вносили в концентрациях 0,2%,
0,4% и 1,0%. Результаты этого эксперимента представлены в табл. 2.
Таблица 2 –
Продуцирование ТФазы E. coli TDP в
зависимости от концентрации лактозы в питательной среде
|
Лактоза, % |
Активность ТФазы |
Биомасса клеток, мг/мл |
|
|
ед/мг |
ед/мл |
||
|
0,2 |
115,3 |
184,5 |
1,6 |
|
0,4 |
139,5 |
251,1 |
1,8 |
|
1,0 |
124,1 |
186,2 |
1,5 |
Из табличных данных видно, что степень индукции ТФазы
зависит от концентрации лактозы. Наибольшая активность фермента (как в ед/мг,
так и в ед/мл) достигается при использовании 0,4% лактозы. Важно отметить, что
при использовании лактозы в любой из проверенных концентраций выход фермента в
расчете на единицу биомассы клеток значительно превышает таковой при
использовании 1,0 мМ IPTG (см. табл. 1). Выход
ТФазы с единицы объема культуральной среды составил 251,1 ед/мл при
использовании 0,4% лактозы, что в 3,5 раза выше, чем при использовании
оптимальной концентрации IPTG.
Таким образом, нами получен генно-инженерный штамм E. coli – суперпродуцент ТФазы и показано, что для
получения биомассы с наибольшей активностью фермента в качестве индуктора
целесообразно использовать лактозу в концентрации 0,4%.
Литература:
1.
Barai V.N., Zinchenko A.I., Eroshevskaya L.A., Kalinichenko E.N., Kulak T.I., Mikhailopulo I.A. // Helvetica Chimica Acta. 2002. Vol. 85, N 7. P. 1901–1908.
2.
Mikhailopulo I.A. //
Curr. Organic Chem. 2007. Vol. 11, № 4. P. 317–335.
3.
Razzel W.E., Khorana
H.G. // Biochim. Biophys. Acta. 1958. Vol. 28, № 3. P. 562–566.
4.
http://www.merckbiosciences.co.uk/docs/docs/PROT/TB055.pdf
// The pET system manual 11th Edition.