Химия и химические технологии / 5.
К.т.н. Родионов И.В.
Саратовский государственный технический
университет
Коррозионные потенциалы парооксидных биопокрытий медицинских титановых имплантатов
Введение
Медицинские имплантаты используются в организме человека как технические
средства для временной или постоянной коррекции функций его органов и систем
при хирургическом лечении их заболеваний и повреждений либо исправлении
дефектов [1]. Материалы таких имплантатов должны обладать биосовместимостью,
предотвращающей изменение их функциональных качеств и появление иммунных
реакций организма [2]. Многие виды имплантатов выполняют механические
функциональные нагрузки, как например, в ортопедии и стоматологии, поэтому для
изготовления таких костных имплантатов применяются материалы с биомеханической
совместимостью. К таким материалам относятся титан, цирконий, тантал, из
которых чаще других используется титан, обладающий благоприятным сочетанием
биомедицинских качеств и технико-экономических показателей.
Наилучшее функционирование титановых имплантатов обеспечивается в условиях их интеграции с биосредой за счет биоэлектрохимического взаимодействия, когда при наличии микронесплошностей поверхности материала в них прорастают клетки биоструктур. Данные процессы характеризуют биоактивность, проявляемую биокерамическими материалами, к числу которых относятся оксиды биосовместимых металлов.
Из применяемых методов оксидирования наилучший комплекс структурных качеств биоактивности формируется при паротермическом оксидировании титана. Функционирование таких титановых оксидированных имплантатов протекает в условиях действия на их поверхность тканевой жидкости, крови, лимфы и других жидких компонентов, присутствующих в структурах организма. Данные жидкости имеют водную основу и обладают свойствами электролитов, оказывая на титанооксидное покрытие имплантатов коррозионное воздействие. Анодные процессы при этом характеризуются ионизацией атомов титана и металлических примесей, диффузией ионов в окружающую биосреду с образованием ее металлоза. Из-за этого меняются состав и свойства поверхности имплантата, а также происходит нарушение нормальных клеточных процессов в биоструктурах, возникает опасность воспалительных явлений и отторжения имплантата, что в значительной степени связано с уровнем коррозионной стойкости покрытий, характеризуемым их фазовым составом и коррозионными потенциалами. Поэтому целью данной работы является определение фазового состава и величины коррозионных потенциалов титанооксидных биопокрытий в зависимости от режима паротермического оксидирования.
Методика исследования
Образцами служили пластины с площадью рабочей поверхности 200 мм2, изготовленные из технического титана ВТ1-00, содержащего до 0,4% примесей, в том числе 0,12% железа как металлическую примесь. Перед паротермическим оксидированием образцы подвергались обдувке струей порошкового корунда Al2O3 дисперсностью 250…500 мкм на установке «Чайка-20» в течение 8 мин при давлении воздуха 0,65 МПа. Благодаря этому в поверхностном слое образцов возникали микродеформации и внутренние напряжения, усиливающие окисление титана. Последующее оксидирование образцов проводилось в печи экспериментальной нагревательной установки при различных режимах, включающих температуру нагрева 450 и 5500С в атмосфере перегретого водяного пара, а также продолжительность оксидирования 1, 2, 3 ч при каждой температуре. Выбранный температурный режим оксидирования позволял избежать образования в поверхностном слое хрупких титанонитридов, возникающих при температурах выше 6000С [3, 4]. Продолжительность оксидирования обеспечивала получение толщины оксидного покрытия не менее 12 мкм для создания его необходимой сплошности и прочности.
Фазовый состав титанооксидного покрытия определялся методом рентгенофазового анализа с помощью дифрактометра ДРОН-4, снабженного рентгеновской трубкой с медным анодом, в CuKα-излучении при сканировании брэгговского угла со скоростью 2 град/мин. Идентификация фаз на получаемых дифрактограммах производилась по картотеке JCPOS (1985 г.).
Коррозионное
поведение
оксидных покрытий оценивалось по величине их электродных потенциалов Ес,
оказывающих главное влияние на термодинамическую устойчивость покрытий в
условиях электрохимической коррозии. Поэтому величина Ес
рассматривалась как коррозионный потенциал покрытия и измерялась при
моделировании процесса взаимодействия титанооксидного покрытия с жидкими
компонентами биосреды на лабораторной установке. Образец размещался в
электрохимической термостатированной двухэлектродной ячейке с электролитом,
моделирующим состав плазмы крови и тканевой жидкости (рис. 1). Он представлял
изотонический раствор 0,9% NaCl в дистиллированной воде с величиной
pH = 7,4, его температура изменялась и составляла значения 25, 30, 35,
40, 450С, что моделировало область нормальной температуры организма
с выходом за ее пределы для возможности установления температурной зависимости
потенциала. Постоянство заданной температуры поддерживалось термостатом типа MLW с
погрешностью ± 0,10С, температурная однородность электролита
обеспечивалась при помощи магнитной мешалки.
Рис.1. Блок-схема установки для измерения коррозионных
потенциалов: Р.Э. – рабочий электрод; Э.С. – электрод сравнения
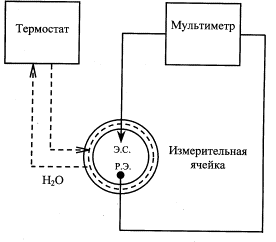
Измерение
установившегося коррозионного потенциала образца после его выдержки в
электролите в течение 10 с производилось относительно насыщенного
хлорсеребряного электрода сравнения. Для регистрации потенциала образец и
электрод сравнения подсоединялись к цифровому мультиметру типа В7-21А [5]. По
данной методике измерялись коррозионные потенциалы у трех образцов с
титанооксидным покрытием каждого типа, после чего рассчитывалось среднее
значение потенциала.
Результаты
исследования и их анализ
Фазовый состав
изучался у титанооксидного покрытия, полученного при наибольших значениях
температуры и продолжительности паротермического оксидирования – t = 5500С, τ = 3 ч, что
повышало вероятность образования в покрытии оксидов и других соединений как
титана, так и примеси железа. Дифрактограмма, полученная в итоге рентгенофазового
анализа, и результаты ее обработки показали, что значения межплоскостного
расстояния d
при различной величине интенсивности дифракционных линий J соответствовали присутствию в покрытии
наибольшего количества фаз титана и его диоксида TiO2 с наличием весьма малого содержания низших оксидов Ti2O3 и Ti3O5 (рис. 2, табл. 1).
паротермическим
оксидированием при t = 5500С и
τ = 3 ч
Рис. 2. Дифрактограмма титанооксидного покрытия, полученного
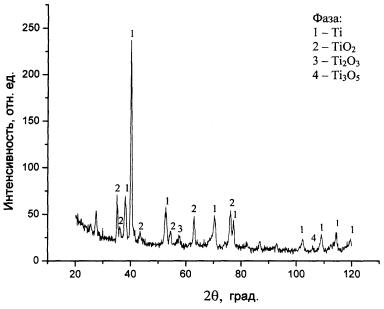
Таблица 1
Результаты
обработки дифрактограммы
титанооксидного
покрытия
|
Ti |
TiО2 |
Ti2О3 |
Ti3О5 |
||||
|
d,
Å |
J, отн. ед. |
d,
Å |
J, отн. ед. |
d,
Å |
J, отн. ед. |
d,
Å |
J, отн. ед. |
|
2,51 |
70 |
2,48 |
55 |
1,53 |
25 |
0,85 |
18 |
|
2,31 |
70 |
2,44 |
37 |
- |
- |
- |
- |
|
2,19 |
237 |
2,12 |
32 |
- |
- |
- |
- |
|
1,67 |
58 |
1,61 |
32 |
- |
- |
- |
- |
|
1,25 |
49 |
1,39 |
48 |
- |
- |
- |
- |
|
1,14 |
44 |
1,15 |
54 |
- |
- |
- |
- |
При фазовом анализе не было
обнаружено присутствия нитридов титана, а также оксидов и нитридов железа,
обладающих высокой хрупкостью и резко снижающих прочность покрытия. Более
низкие значения температуры и продолжительности оксидирования приблизили бы к
нулю содержание низших оксидов и вероятность образования нитридов титана.
Полученные данные позволяют считать, что принятые режимы паротермического
оксидирования обеспечивают формирование однофазного титанооксидного покрытия с
однородным структурным состоянием и свойствами.
Коррозионное поведение покрытий характеризовалось положительными
значениями их электродных потенциалов Ес при всех принятых режимах оксидирования и
температурах электролита (табл. 2). Это указывает на термодинамическую
устойчивость покрытия и его сопротивляемость коррозии в электролите,
моделирующем состав плазмы крови и тканевой жидкости.
Температура оксидирования 4500С
с продолжительностью 1 и 2 ч придавала покрытию величину потенциала, мало
зависящую от нагрева электролита и находящуюся в пределах 0,103…0,124 В.
Увеличение продолжительности оксидирования до 3 ч приводило к некоторому
повышению потенциала до уровня 0,121…0,136 В.
Температура оксидирования 5500С
с продолжительностью 1 ч обусловливала величину потенциалов, соответствующую
уровню потенциалов покрытия, полученного при температуре 4500С и
продолжительности 3 ч. С повышением продолжительности оксидирования до 2 ч
наблюдалась сильная зависимость потенциала от нагрева электролита. Так, рост
температуры электролита от 25 до 450С вызывал почти двукратное
снижение потенциала покрытия – от 0,313 В до 0,178 В. Продолжительность
оксидирования в течение 3 ч приводила к образованию наиболее низких значений
потенциала покрытия на уровне 0,057…0,065 В.
Таблица 2
Результаты измерения потенциала коррозии титанооксидных покрытий,
полученных при различных режимах оксидирования
|
Температура паротермического
оксидирования t, °С |
Продолжительность оксидирования
τ, ч |
t, °С модельного электролита |
||||
|
25 |
30 |
35 |
40 |
45 |
||
|
Ес покрытия, мВ (н.х.с.э) |
||||||
|
450 |
1 |
109 |
106 |
103 |
104 |
113 |
|
2 |
108 |
111 |
110 |
124 |
121 |
|
|
3 |
130 |
136 |
134 |
121 |
122 |
|
|
550 |
1 |
118 |
133 |
136 |
133 |
130 |
|
2 |
313 |
268 |
250 |
189 |
178 |
|
|
3 |
57 |
65 |
65 |
62 |
62 |
|
Данные результаты исследования
характеризуют сильную зависимость изменения коррозионного потенциала
титанооксидного покрытия от режима паротермического оксидирования, при этом
наибольшее влияние оказывает температура оксидирования. Материалы ранее
проведенных коррозионных испытаний позволяют считать, что главную роль в
полученной зависимости играет изменение фазово-структурного состояния покрытия,
в первую очередь, морфологическая гетерогенность поверхности и степень ее
пористости [1].
Согласно имеющимся данным с
увеличением показателей микрошероховатости, уменьшением размера частиц
макрорельефа и повышением пористости поверхности возрастает физическая площадь
ее контакта с электролитом, увеличивается электрохимическая гетерогенность. При
этом донная часть возникающих трещин, пор, углублений отличается более
отрицательным потенциалом по сравнению со стенками данных элементов рельефа. В
указанных условиях термодинамическая устойчивость поверхности снижается при
уменьшении ее коррозионного потенциала и повышении склонности к коррозии.
При температуре оксидирования 4500С
невысокая скорость реакционной диффузии атомов титана и кислорода в течение 1 и
2 ч создает небольшое различие в размерах морфологических частиц, пор и степени
пористости получаемых покрытий, что сближает значения их потенциалов. Повышение
продолжительности оксидирования до 3 ч заметно увеличивает толщину покрытия и
сглаживает макрорельеф поверхности, повышая ее склонность к пассивации и
величину электродного потенциала.
При температуре 5500С
и продолжительности 2 ч размер макрочастиц на поверхности покрытия значительно
повышается, а пористость уменьшается, что увеличивает термодинамическую
устойчивость и значение электродного потенциала. Сильное падение потенциала при
увеличении нагрева электролита может быть связано с ростом активности его
ионов, для продвижения которых вглубь данная структура оказывает наименьшее
сопротивление.
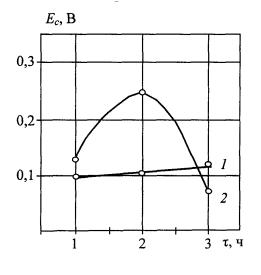 Увеличение
продолжительности оксидирования до 3 ч создает повышенную толщину покрытия с
возрастанием его внутренних напряжений. Это вызывает значительный рост размера
трещин, пор и степени пористости, снижая величину потенциала поверхности от
0,240 В до 0,064 В при температуре электролита, соответствующей норме для
организма (рис. 3). Данное снижение потенциала свидетельствует об уменьшение
электрохимического сопротивления покрытия протеканию коррозионных процессов.
Увеличение
продолжительности оксидирования до 3 ч создает повышенную толщину покрытия с
возрастанием его внутренних напряжений. Это вызывает значительный рост размера
трещин, пор и степени пористости, снижая величину потенциала поверхности от
0,240 В до 0,064 В при температуре электролита, соответствующей норме для
организма (рис. 3). Данное снижение потенциала свидетельствует об уменьшение
электрохимического сопротивления покрытия протеканию коррозионных процессов.
Рис. 3. Влияние
продолжительности паротермического оксидирования на изменение потенциала коррозии
Ес титанооксидного покрытия при температуре электролита
36,60С: зависимость 1 – t = 4500С; зависимость 2 – t = 5500С
Полученные результаты исследования и их анализ позволяют рекомендовать применение паротермического оксидирования при температуре 5500С в течение 2 ч для получения однофазного, структурно гетерогенного титанооксидного биопокрытия на костных имплантатах длительного функционирования с наилучшим уровнем коррозионной стойкости при взаимодействии с окружающей биосредой. Для чрескостных ортопедических и других временных имплантатов более целесообразным является режим оксидирования при температуре 5500С и продолжительности 3 ч за счет чего создается структурное состояние покрытия с увеличенной пористостью и высоким уровнем шероховатости, обеспечивающих формирование повышенных качеств биоактивности.
Выводы
Оксидирование титана при температуре
5500С в течение 3 ч обеспечивает получение оксидного покрытия,
содержащего, в основном, фазу диоксида титана с небольшим количеством других
его оксидов. Такой однофазный состав позволяет предположить наличие у покрытия
однородной структуры и свойств.
Коррозионное поведение оксидированного
титана в электролите, моделирующем жидкие компоненты биосреды,
характеризовалось сильной зависимостью от режима оксидирования. При этом
наибольшее влияние оказывала температура оксидирования, так что при значениях t =
5500С и τ = 2 ч наблюдалась наилучшая коррозионная стойкость с
величиной потенциала Ес = 0,31 В. Данный режим рекомендуется
для паротермического оксидирования костных титановых имплантатов с высокой
коррозионной стойкостью оксидного покрытия при функционировании.
Литература
1.
Вильямс Д.Ф., Роуф Р. Имплантаты в хирургии. Пер. с англ. М.: Медицина, 1978.
552 с.
2. Бутовский К.Г., Лясникова А.В.,
Лепилин А.В., Лясников В.Н. Биоактивные материалы и покрытия в дентальной
имплантологии. – Саратов: Сарат. гос. техн. ун-т, 2004. 94 с.
3.
Войтович Р.Ф., Головко Э.И. Высокотемпературное окисление титана и его сплавов.
Киев: Наук. думка, 1984. 256 с.
4. Гладкова Е.Н. Теоретические основы и
технология паротермического оксидирования. – Саратов: Изд-во Сарат. ун-та,
1973. С. 103.
5. Серянов Ю.В., Фоменко Л.А., Барабанов С.Н., Родионов В.В. Методы электрохимических исследований. – Саратов: Сарат. гос. техн. ун-т, 2005. 188 с.