М.В. Сопова, А.Г. Козьмина, Е.Н. Кириллова, Б.А. Ивин
Санкт-Петербургская
государственная химико-фармацевтическая академия
Синтез новых потенциальных биологически активных соединений среди
продуктов взаимодействия 2-арил-4-гидрокси-6Н-1,3-тиазин-6-онов и их N-алкилазааналогов с
алифатическими и ароматическими альдегидами.
Известно,
что барбитуровая и 2-тиобарбитуровая кислоты при взаимодействии с
ароматическими альдегидами дают производные 5-арилиденбарбитуровых и
5,5’-арилиденбисбарбитуровых кислот [1], 4,6-дигидроксипиримидины реагируют с ароматическими
альдегидами, образуя 5-арилиденпиримидины,
5,5’-арилиденбис(4,6-дигидроксипиримидины) [2]. . Кроме того, в ряде случаев были получены пирано[2,3-d]пиримидины [3]. Среди продуктов взаимодействия 2-арил-4-гидрокси-1,3-тиазинов
с электрофильными и нуклеофильными реагентами были обнаружены вещества,
обладающие широким спектром биологической активности. Взаимодействие
N-алкил-2-замещенных-4,6-дигидроксипиримидинов и их тиааналогов – 1,3-тиазинов
с различными электрофильными реагентами, в том числе и с карбонильными
соединениями, до сих пор не исследовались. В связи с
этим мы исследовали конденсацию 2-арил-4-гидрокси-1-метилпиримидин-6-онов
(I а-в) и их тиааналогов
2-арил-4-гидрокси-6H-1,3-тиазин-6-онов (IV а-в) с формальдегидом,
ароматическими и алифатическими альдегидами, продолжая поиск новых биологически
активных веществ среди производных азинов.
5,5’-(Алкил/арил)метиленбис(2-арил-6-гидрокси-3-метилпиримидин-4(3H)-оны) (III а-и) получены конденсацией пиримидинов (Iа-в) с формальдегидом, алифатическими
и ароматическими альдегидами. Реакцию с
формальдегидом проводили в полярных апротонных (ацетонитрил, пиридин) и
протонных (уксусная кислота, этанол) растворителях, с ароматическими
альдегидами (VIII а-е)
в пиридине при
50°C, или в кипящем этаноле, с
алифатическими альдегидами (VIII ж, з) в ледяной уксусной кислоте при 20°C,
или в 5% растворе гидрокарбоната натрия (схема).
Схема
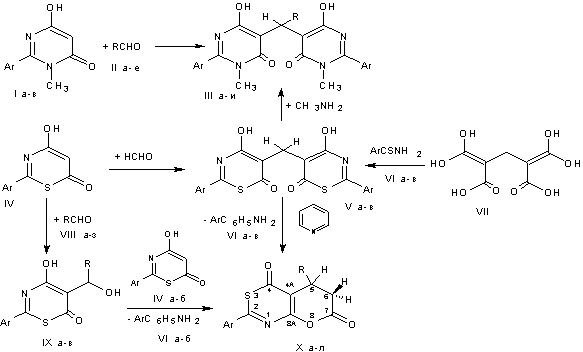
I, IV, V, VI: Ar = C6H5 (а), 4-MeOC6H4 (б); 4-ClC6H4 (в);
II: R = H (а), 4-O2NC6H4 (б), 4-NСC6H4 (в), 4-(CH3)2NC6H4
(г), CH3 (д), CH2CH(CH3)2
(е);
III: Ar = C6H5, R = H (а), 4-O2NC6H4 (г), 4-NСC6H4 (д), 4-(CH3)2NC6H4 (е), Ar = 4-MeOC6H4,
R = H (б), 4-O2NC6H4 (ж), CH3 (з), CH2CH(CH3)2 (и), Ar = 4-ClC6H4, R = H (в);
VIII: R = C6H5 (а), 4-O2NC6H4 (б), 4-ClC6H4 (в), 4-NСC6H4 (г);
4-Н3СC6H4 (д), 4-(H3C)2NC6H4 (е), C2H5 (ж), CH2CH(CH3)2 (з);
IX: Ar = 4-MeOC6H4,
R = 4-O2NC6H4 (а), 4-ClC6H4 (б), 4-NСC6H4 (в);
X: Ar = C6H5, R
= H (а), C6H5 (г), 4-ClC6H4 (д), C2H5 (к), CH2CH(CH3)2 (л), Ar = 4-MeOC6H4,
R = H (б), C6H5 (е),4-Н3СC6H4 (ж), 4-O2NC6H4 (з), 4-(H3C)2NC6H4 (и), Ar = 4-ClC6H4, R = H (в).
5,5’-Метиленбис(2-арил-4-гидрокси-6H
1,3-тиазин-6-оны) (Vа-в) получены взаимодействием
1,3-тиазинов (III а-в) с формальдегидом при
температуре 20 ° C в уксусной кислоте, в других растворителях (этаноле,
ацетонитриле и этилацетате) реакция протекает аналогично. 2-Арил-5,6-дигидро-4H,7H-пирано[2,3-d]-1,3-тиазин-4,7-дионы (X а-в) получены рециклизацией 5,5’-метиленбистиазинов
(V а-в) в пиридине при
нагревании до 50 °C, а 2,5-диарил-5,6-дигидро-4H,7H-пирано[2,3-d]-1,3-тиазин-4,7-дионы (X г-и) и 2-арил-5-алкил-6,7-дигидро-4H,5H-пирано[2,3-d]-1,3-тиазин-4,7-дионы (X к, л) – взаимодействием 1,3-тиазинов (III а, б) с ароматическими (VIII а-е) и алифатическими (VIII ж, з) альдегидами в пиридине при 18-50 °C. Для ароматических альдегидов (VIII а-е) возможно проведение реакции при кипячении в
ледяной уксусной кислоте, или диоксане, а также в отсутствие растворителя при
140 °C. При продолжительном (72-98 ч)
взаимодействии тиазина (IV б) с избытком
альдегида (VIII б-г) при 20-25 °C в ледяной уксусной кислоте был выделен 4-гидрокси-5-[гидрокси(арил)метил]-2-арил-6H-1,3-тиазин-6-он (IX а-в). Соединения V а-в и III а-в также были получены встречным
синтезом: 5,5’-метиленбистиазины (Vа-в) из тиобензамидов (VI а-в) и 1,1,3,3-пропантетракарбоновой кислоты (VII), а 5,5’метиленбиспиримидины (III а-в)
взаимодействием 5,5’-метиленбистиазинов
(Vа-в) с метиламином. Спектральные характеристики и
физико-химические свойства образцов веществ V а-в и III а-в, полученных разными методами
идентичны (схема).
Изучена острая токсичность синтезированных соединений (II a, V
а-в, X г-л), а также
анальгезирующая и антимикробная активность (II a, V
а-в), антигипоксическая, седативная,
противовоспалительная ипротивосудорожная активность (X
г-л). Индивидуальность полученных соединений была доказана методом тонкослойной
хроматографии, состав – масс спектрометрией и элементным анализом, строение –
УФ, ИК-, 1H и 13C
ЯМР-спектроскопией.
Литература
[1]
Дьячков А.И., Ивин Б.А., Сморыго Н.А., Сочилин Е.Г. Исследования в ряду
пиримидинов. XXVII. Конденсация
2-тиобарбитуровых кислот с бензальдегидами. Состав и строение продуктов реакции
в некоторых растворителях. // ЖОрХ, 1976, Т. 12. Вып. 5 С. 1115-1122.
[2] Москвин А.В., Резникова Н.Р., Ивин Б.А.Взаимодействие 4,6-диоксипиримидинов с
салициловыми альдегидами// Москвин, А. В., Резникова, Н. Р., Ивин, Б.
А., ЖОХ, 1999, Т. 69. Вып. 4. С. 644-653.
[3] Figueroa-Villar, J. D., Cruz, E. R. A simple approach toward the synthesis of
oxadeazaflavines //. Tetrahedron. 1993. Vol. 49. N 14. P. 2855-2862.