К.ф-м.н. Валуева
С.В., Боровикова Л.Н., Суханова Т.Е., Вылегжанина М.Э.
Учреждение Российской академии наук Институт высокомолекулярных
соединений РАН, Санкт-Петербург,
Россия
СЕЛЕНСОДЕРЖАЩИЕ БИОЛОГИЧЕСКИ АКТИВНЫЕ НАНОМАТЕРИАЛЫ: СИНТЕЗ И МОРФОЛОГИЯ
Свойства веществ и материалов, образованных структурными элементами с размерами в нанометровом интервале, в объемной фазе не определяются однозначно. Изменения характеристик обусловлены не только уменьшением размеров структурных элементов, но и проявлением квантовомеханических эффектов, волновой природой процессов переноса и доминирующей ролью поверхностей раздела. Управляя размерами и формой наноструктур, таким материалам можно придавать совершенно новые функциональные характеристики, резко отличающиеся от характеристик обычных материалов. Регулируемое создание наноструктур должно привести, в частности, к созданию новых биосовместимых материалов с повышенными характеристиками. Молекулярные составляющие биологических систем (белки, нуклеиновые кислоты, липиды, углеводы и их биологические аналоги) являются примерами материалов, чья структура и свойства определяются в наномасштабе. Многие природные наноструктуры и наносистемы образуются при помощи биологических методов самосборки. Искусственные неорганические и органические наноматериалы могут вводиться в клетки, использоваться для диагностики (например, с помощью создания визуализируемых квантовых «точек») и применяться в качестве их активных компонентов. Перечислим некоторые перспективные применения нанотехнологий в медицине: искусственные неорганические и органические наноматериалы могут вводиться в клетки, использоваться для диагностики (например, с помощью создания визуализируемых квантовых «точек») и применяться в качестве их активных компонентов; новые методы введения и распределения лекарств в организме, что имело бы большое значение для повышения эффективности лечения (например, доставка препаратов к определенным местам в организме); разработка более стойких и не отторгаемых организмом искусственных тканей и органов; разработка сенсорных систем, которые могли бы сигнализировать о возникновении болезней внутри организма, что позволило бы врачам заниматься не столько лечением, сколько диагностикой и предупреждением заболеваний.
В
результате самоорганизации и самосборки могут формироваться супрамолекулярные
структуры различной морфологии, в частности, наноструктуры типа «ядро-оболочка».
Особый интерес представляют
наносистемы на основе биогенного элемента – селена. Наночастицы наноаморфного селена (нано-а-Se0) с
размерами 3-500 нм уже используются в качестве высокочувствительных биосенсоров
для иммуноанализа и хроматографически мобильных аффинных реагентов. Даже при
очень низких концентрациях селена в воде (0.005-0.1%), его частицы могут адсорбировать
на своей поверхности антигены и антитела. Известно, что селен, входящий в
состав пищевых продуктов, оказывает антибластическое действие, а между
содержанием селена во внешней среде и частотой поражения населения
злокачественными опухолями существует обратно пропорциональная зависимость [1].
Известно также, что в условиях дефицита селена наблюдается развитие
миокардиодистрофии, атеросклероза, ишемической болезни сердца, инфаркта миокарда и хронического гепатита
различной этимологии [2,3].
В ряде работ нами было показано, что новые высокоэффективные перевязочные
и шовные материалы с антимикробной, противовирусной, репаративной и
имунностимулирующей активностью могут быть получены на основе наночастиц нано-а-Se0, стабилизированных
поли-N-винилпирролидоном (ПВП) [4]. Более того, установлено, что в отличие от
свободных частиц селена, частицы нано–а–Se0–ПВП также оказывают и
противоопухолевое действие. На клетках
промиелоцитарной лейкемии HL-60 было показано,
что наносистемы Se0–ПВП и нано–а–Se0–БСА
ингибируют клеточный рост пропорционально увеличению их концентрации, и
вызывают полную гибель клеток при концентрации 200 мкМ [5].
Ранее нами было показано [6-11],
что при восстановлении ионов селена в растворах полимеров протекают два
процесса – образование наночастиц селена с узким унимодальным распределением по
размерам и адсорбция на них макромолекул. Это сопровождается формированием органической оболочки на
неорганическом ядре и приводит к снижению поверхностного натяжения,
стабилизации образующихся наночастиц от их агрегации, торможению роста, а также
повышению их устойчивости к окружающей среде.
С
целью создания новых высокоэффективных селенсодержащих лекарственных средств
нами были получены селенсодержащие
биологически активные наносистемы на основе полимерных матриц различной природы
в широком диапазоне варьирования массового соотношения селен:полимер ν
(ν = 0.025 - 0.2) и проведено
комплексное исследование методами спектрофотомерии, динамического
светорассеяния (ДСР) и атомно-силовой микроскопии (АСМ).
Селенсодержащие наносистемы получали восстановлением селенистой кислоты
аскорбиновой кислотой в водной
среде в присутствии полимерных стабилизаторов
(ПС) различной природы: ПВП, оксиэтилцеллюлозы (ОЭЦ), поли-N,N,N,N–триметилметакрилоилоксиэтиламмоний
метилсульфата (ПТМАЭМ), поли-2-акриламидо-2-метилпропансульфокислоты
(ПАМС) и полиметакриловой кислоты (ПМАК). Структурные формулы и ММ ПС
приведены в таблице 1. Синтез всех нанокомпозитов
осуществлялся по единому принципу, описанному в работах [6-11]. Реакция
проводилась в водной среде, в условиях (рН=3,3), когда согласно данным [12]
селенистая кислота практически не диссоциирует. Условия проведения реакции
нано–Se0 в
растворе полимера выдерживались постоянными:
при Т=293К и атмосферном давлении. Для изучения кинетики реакции
формирования нанокомпозитов и
структурных особенностей наносистем был выбран ряд ν (ν = 0.025; 0.05; 0.1; 0.15; 0.2, где ν -
отношение массовой концентрации селена к концентрации полимера ν= cse/cp).
Таблица 1. Структурные
формулы и ММ ПС.
|
ПС |
Структурная формула |
|
ПВП Mw=23×103 |
-[-CH2-CH-]n- ê
N / \ О=С CH2 ê ê Н2 С — CH2 |
|
ПДМАЭМ Mw=170×103 |
СНз | -[-СН2-С-] n – | О=С-O-(СН2)2-N+(СНз)з
• СН3 SO4–
|
|
ПАМС Mw=2,5×106 |
-[- CH2- CH-]n- ç O=C-NH-C(CH3)2-СН2- SO3-
•Н+ |
|
ПМАК Mw=35×103 |
СНз | -[-СН2 - С-] n – | О=С-OH |
|
ОЭЦ Mw=150×103 |
C6H7O2(ОН)3-x[(OCH2CH2)y(OH)x] |
Концентрация полимеров выдерживалась постоянной во
всех случаях и составляла 0,1мас.%. Восстановление
селенистой кислоты H2SeO3 аскорбиновой
кислотой C6H8O6 в водной среде согласно уравнению реакции (1)
H2SeO3+ 2C6H8O6
→ Se+3H2O+ 2 C6H6O6 (1)
приводит к образованию золя нуль –
валентного селена Se0 (в виде красно - оранжевого раствора) и
дегидроаскорбиновой кислоты. Золь неустойчив в растворе и выпадает в осадок
через 24 часа, а через 7 -10 суток селен из аморфной красной формы переходит в другую свою модификацию – серый металлический
селен. Образованиенуль-валентного селена в результате выбранной реакции
соответствует ранее проведенным работам [6-11].
Величины константы скорости k* реакции формирования нанокомпозитов были рассчитаны
по методу Гуггенгейма (предложенному для реакций первого и псевдопервого
порядков) по формуле k* = log(Dk/(Dk – Di))/ti, где Dk –
оптическая плотность, характеризующая окончание процесса, Di – оптическая плотность в данный момент времени ti. Методом динамического светорассеяния определяли
средние гидродинамические размеры наноструктур Rh*.
Радиусы эквивалентных гидродинамических сфер Rh* рассчитывали
из значений коэффицентов диффузии (D*) по уравнению Эйнштейна – Стокса Rh* = kT/6πη0D* (η0 –
вязкость растворителя). Изучение
топографии поверхности тонких пленок, полученных из водных растворов ПС-нано-а-Se0, проводили
методом атомно-силовой микроскопии (АСМ) на приборе Nanotop NT-206
(«Микротестмашины», Беларусь). Каплю раствора наносили на покровное стекло и
высушивали на воздухе при комнатной температуре. Измерения проводили в
контактном режиме в атмосферных условиях с использованием кремниевых
кантилеверов NSG 01. Обработка
экспериментальных данных производилась с помощью программы Surface View 1.0.
Известно,
что синтез наносистем – сложный процесс, зависящий от многих параметров, в том
числе, молекулярной массы ПС, структуры мономерного звена, жесткости полимерной
цепи, наличия и знака заряда. Поэтому, необходимо учитывать всю совокупность
характеристик ПС, которые будут играть различную по значимости роль на разных
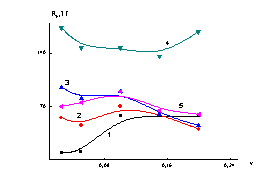
стадиях процессов формирования и самоорганизации наносистемы. В таблице 2 приведены значения константы
скорости процесса самоорганизации селенсодержащих наносистем k* для различных ПС при варьировании ν. Видно, что
в области ν = 0.05 и ν > 0.1 наблюдается увеличение значений
параметра k* в следующей последовательности:
ПТМАЭМ (поликатион) ≤ неионогенные полимеры < ПАМС (полианион). Таким
образом, знак заряда на макромолекулах ПС играет определяющую роль в
исследуемом процессе.
Следует отметить, что при
соотношении компонентов ν = 0.1 параметр k* возрастает в ряду:
ПМАК< ПТМАЭМ < ПВП < ПАМС < ОЭЦ. То есть, в данном случае
влияние зарядовых характеристик на величину k* нивелируется совокупностью других выше указанных
параметров.
Таблица
2. Константы скорости процесса самоорганизации селенсодержащих наносистем k* и гидродинамические
радиусы Rh* образующихся наноструктур для различных ПС при варьировании ν.
|
ν |
k*×103,c-1 |
Rh*, нм |
||||||||
|
1 |
2 |
3 |
4 |
5 |
1 |
2 |
3 |
4 |
5 |
|
|
0.025 |
0.73 |
0.47 |
0.36 |
0.3 |
0.5 |
9 |
55 |
95 |
173 |
70 |
|
0.05 |
0.92 |
0.48 |
1.14 |
0.8 |
0.5 |
10 |
45 |
80 |
147 |
75 |
|
0.1 |
1.38 |
0.54 |
1.83 |
3.7 |
0.4 |
57 |
70 |
90 |
147 |
90 |
|
0.15 |
1.42 |
2.48 |
4.33 |
4.0 |
2.3 |
57 |
60 |
60 |
136 |
65 |
|
0.2 |
1.48 |
1.28 |
7.63 |
5.4 |
3.7 |
57 |
40 |
45 |
138 |
60 |
Обозначения: 1-ПВП; 2-ПТМАЭМ; 3-ПАМС; 4-ОЭЦ; 5-ПМАК
Сравнение зависимостей
R*h = f(ν) для
ПВП и ПТМАЭМ (рис. 2) показывает, что они симбатны зависимостям k* = f(ν) (рис.
1), а для ПАМС и ОЭЦ зависимости размерных
характеристик имеют, в целом, убывающий характер, что антибатно соответствующим
зависимостям k* от ν для этих ПС (рис. 1 и 2). Для ПМАК зависимость R*h = f(ν) имеет экстремальный характер с максимумом при
ν = 0.1 и не коррелирует с зависимостью k* = f(ν) (рис.
2). Таким образом, в многокомпонентных системах с конкурентными вкладами
различных параметров строгой зависимости величины k* от одного из параметров ПС не наблюдается, а
величина R*h в
значительной мере определяется термодинамической
жесткостью макромолекул ПС. Важно отметить, что во всем диапазоне ν
размеры наноструктур (за исключением наноструктур на основе жесткоцепного
полимера ОЭЦ) не превышают 100 нм (таблица 2).
При получении
селенсодержащих наносистем могут реализоваться два типа стабилизации:
стерическая или электростерическая стабилизация наночастиц Se полимерной матрицей. Согласно литературным данным
[13], стерическая стабилизация в водных средах базируется на двух эффектах: (1)
энтропийном эффекте, вызываемом уменьшением конфигурационной свободы полимерных
цепей в области между частицами за счет гидрофобных взаимодействий и (2) осмотическом
эффекте, возникающем из-за повышенной концентрации полимера в области между
частицами.
|
|
|
Напротив, в случае полиэлектролитов
осуществляется электростерическая стабилизация наночастиц в водной среде,
которая представляет собой комбинацию двух типов взаимодействий:
электростатического отталкивания и энтропийно-осмотического эффекта. По типу
стабилизации, выбранные нами ПС можно разделить на две группы: в первую группу
входят ПВП, ОЭЦ и ПМАК (в исследуемой области рН = 3.1-3.3 ПМАК находится в
неионизованном состоянии), при использовании которых реализуется стерическая
стабилизация; вторую группу образуют ПС, находящиеся в ионизованном состоянии –
ПТМАЭМ и ПАМС. Формирование селенсодержащих наносистем на основе ПТМАЭМ и ПАМС
происходит по механизму электростерической стабилизации. Стерическая
стабилизация для ярко выраженных гидрофобных ПС, таких как ПМАК, за счет
усиления энтропийного эффекта, должна приводить к более плотной упаковке полимерных
макромолекул на нанокластерах Se, чем в случае
электростерической стабилизации (при использовании ПТМАЭМ и ПАМС) или
стерической стабилизации с менее выраженным энтропийным эффектом (ПВП и ОЭЦ).
|
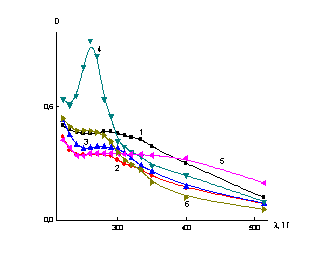
Рис. 3. Зависимость оптической плотности D от длины волны λ для селенсодержащих нанокомпозитов на основе разных ПС при ν =0,1: 1- без ПС; 2- с ПВП; 3- с ПАМС; 4- с ПМАК; 5- с ПДМАЭМ; 6- с ОЭЦ. |
Следует отметить также, что величина оптической
плотности сильно различается для всех нанокомплексов при фиксированном массовом соотношении селен : полимер
ν (например, при ν=0.1).
Наибольшее значение оптической плотности наблюдается для селенсодержащего нанокомпозита на основе ПМАК,
что можно объяснить максимальной гидрофобностью этого ПС и одновременно отсутствием электростатических
взаимодействий. |
По-видимому, стерическая стабилизация, для сильно
гидрофобных ПС (ПМАК) должна приводить к более плотной упаковке органического
вещества на нанокластере селена, чем в случае электростерической стабилизации
(ПДМАЭМ и ПАМС) или стерической стабилизации с менее выраженным гидрофобным
эффектом.
Результаты
определения размеров образующихся
селенсодержащих наноструктур в области
насыщения адсорбционной емкости ν = 0.1, полученные методом ДСР, хорошо согласуются с данными, полученными
методом АСМ. На рис. 4 приведены АСМ изображения поверхности тонких пленок,
полученных из растворов ПМАК-нано-а-Se0, ПТМАЭМ-нано-а-Se0 и ПАМС-нано-а-Se0 при ν = 0.1. На поверхности всех
образцов хорошо видны изолированные наноструктуры, имеющие четкую сферическую
форму. Оценка размеров наноструктур дает диапазон значений радиусов RАСМ = 50 -
120 нм для ПМАК-нано-а-Se0 (по данным ДСР Rh*= 90 нм (таблица 2); наносистема
ПТМАЭМ-нано-а-Se0 представляет
собой в основном изолированные частицы с размерами RАСМ = 70 -
300 нм (Rh* = 70 нм),
достаточно равномерно распределенные по поверхности пленки; для ПАМС-нано-а-Se0 наблюдаются как отдельные частицы с размерами
RАСМ = 90 -
280 нм (Rh*= 90), так и агрегаты,
состоящие из 3-5 частиц.
|
а |
б |
в |
Рис. 4. АСМ изображения поверхности тонких пленок, полученных из водных растворов композитов при ν = 0.1: а- ПМАК-нано-а-Se0; б- ПТМАЭМ-нано-а-Se0 ; в - ПАМС-нано-а-Se0. Площадь сканирования 3×3μm2.
Таким образом, установлено, что природа полимерной
матрицы оказывает существенное влияние на процесс самоорганизации наноструктур
и их размеры. Экспериментально показано, что в области насыщения адсорбционной емкости наночастиц селена,
образуются селен – полимерные
наноструктуры сферической формы.
Для анализа цитотоксичности из ряда полученных систем
была выбрана наносистема на основе физиологически активного полимера ПВП.
Оценку цитотоксичности проводили на клетках «ФЛЕЧ». Установлен диапазон
концентраций Se, в котором наносистема ПВП-нано-а-Se0 не
показала токсичности, но сохранила биологическую активность. Это открывает перспективы использования
селенсодержащих нанокомплексов в
качестве лекарственных препаратов широкого спектра действия, в частности –
противоопухолевых препаратов и
препаратов, компенсирующих дефицит селена в организме.
Работа выполнена при поддержке РФФИ, проект №
10-03-01075.
Литература
1.
Yoshizawa, K., Willett, W.C., Morris, S.J. Study
of prediagnostic selenium
levels in toenails and the risk of advanced prostate
cancer// J.Natl.Cancer
Inst. 1998.V. 20. P. 1219-1224.
2.
Абдуллаев, Г.М., Зейналлы,
Э.М., Сафаров, Ю.И. Об изменениях концентрации селена при заболеваниях гепатобилиарной
системы // Врачебное дело. 1978. №11. С.35-37.
3.
Yu, S.Y., Zhu, Y.J., Li, W.G. Chemoprevention trial of human hepatitis with
selenium supplementation in China // Biol.
Trace Element Res. 1997.V. 51. № 1. P.117-124.
4.
Копейкин, В. В., Валуева,
С. В., Киппер, А. И., Боровикова, Л. Н., Филиппов, А. П. Синтез наночастиц селена
в водных растворах поливинилпирролидона и морфологические характеристики
образующихся нанокомпозитов// Высокомолек. соед. 2003.Т. 45 А. №4. С. 615-622.
5.
Валуева, С.В.,
Боровикова, Л.Н., Коренева, В.В., Назаркина, Я.И., Киппер, А.И, Копейкин, В.В. Структурно-морфологические и биологические
свойства наночастиц селена стабилизированных бычьим сывороточным альбумином// Журн.
физ. химии. 2007. Т.81.№ 1. С.1329-1333.
6.
Валуева, С.В., Боровикова, Л.Н., Вылегжанина, М.Э.,
Суханова, Т.Е. Морфология и термодинамические характеристики селенсодержащих
наноструктур на основе полиметакриловой кислоты// Журн.физ. химии.- 2010. Т. 84. № 9. С.1619-1623.
7.
Валуева, С. В., Киппер, А. И., Боровикова, Л. Н.,
Матвеева, Н. А. Влияние природы
наночастицы и полимерной матрицы на морфологические характеристики полимерных
наноструктур// Журн.физ. химии. 2010.
Т. 84. № 12. С. 2110-2115.
8.
Валуева С.В, Киппер А. И., Копейкин В.В,
Боровикова Л.Н., Иванов Д. А., Филиппов А. П.
Влияние молекулярной массы
полимерной матрицы на морфологические характеристики селенсодержащих
наноструктур и на их устойчивость к воздействию гидродинамического поля // Выcокомолек. соед. 2005.Т.47А. №3. С.438-443.
9.
Копейкин, В. В., Валуева, С. В., Киппер, А.
И., Калинина, Н. А., Силинская, И. Г., Хлебосолова, Е. Н., Шишкина, Г. В.,
Боровикова, Л.Н. Самоорганизация молекул поли-2-акриламидо-2-
метилпропансульфокислоты и додецилсульфата натрия на наночастицах
нульвалентного селена//Высокомолек. соед. 2003. Т. 45 А. № 6. С. 963-969.
10.
Копейкин, В.В., Валуева,
С.В., Киппер, А.И., Боровикова, Л.Н., Назаркина, Я.И., Хлебосолова, Е.Н.,
Филиппов, А.П. Эффект адсорбции оксиэтилцеллюлозы на наночастицах селена в
процессе их формирования в воде// ЖПХ. 2003. Т. 76. № 4. С. 621-623.
11.
Копейкин, В.В., Валуева,
С.В., Киппер, А.И., Филиппов, А.П., Хлебосолова, Е.Н., Боровикова, Л.Н.,
Лаврентьев, В.К. Исследование формирования частиц нано-Se0в водном
растворе катионного полиэлектролита// ЖПХ. 2003. Т. 76. № 5. С. 847-851.
12.
Walrafen, G.E. Raman Spectral Studies of Aqueous Solutions of Selenious Acid// J. Chem. Phys. 1962. V. 36.№ 90. P. 9-1.
13.
Mayer, A.B.R. Colloidal Metal Nanoparticles Dispersed in
Amphiphilic Polymers// Polym. Adv. Technol.
2001.V.12. P. 96 -106.