Неорганическая химия
Д.х.н. Янкин А.М., к.х.н. Ведмидь Л.Б., к.х.н.
Фёдорова О.М.,
д.х.н.
Балакирев В.Ф.
Институт металлургии УрО РАН.
P-T-x –диаграмма системы Ho-Mn-O
Интерес к материалам на основе манганитов Р.З.М. вызван их уникальными служебными
характеристиками. Первым этапом при проведении физико-химического анализа
многокомпонентных систем является построение их диаграмм состояния. Большинство
фазовых диаграмм построены на воздухе при переменной температуре (изобарические
разрезы диаграмм состояния при Ро2 = 21кПа), однако положение
фазовых границ и физических свойств получаемых соединений в значительной
степени зависит и от давления кислорода. Поэтому особую ценность имеют
диаграммы состояния, выполненные в координатах “состав- температура – давление
кислорода” (P-T-x-диаграммы).
Топография таких диаграмм обсуждена в [1]. P-T-x –диаграмма системы Ho-Mn-O (973-1190К)
построена на основе изучения
диссоциации оксидов HoMnO3 и HoMn2O5,
проведенного статическим методом изучения гетерогенных равновесий в вакуумной
циркуляционной установке [2], парциальное равновесное давление кислорода
измерено методом ЭДС с твёрдым О2-ионным электролитом. Исходные
оксиды HoMn2O5 и HoMnO3 получены по керамической технологии на воздухе из
оксидов Ho2O3 марки ГоО-Е (ОСТ 48-206-81) и Mn2O3
квалификации “ос.ч.” Рентгенофазовый анализ исходных образцов и продуктов
диссоциации выполнен с использованием
дифрактометра XRD-700 фирмы Shimadzu в CuKa-излучении. Структурные характеристики полученных
оксидов: исходный HoMn2O5
–орторомбическая сингония (пространственная группа Pbam) [3], параметры элементарной ячейки а=0,7274(5)нм,
b=0,84954(5)нм, с=0,56824(4)нм; исходный HoMnO3
–гексагональная сингония (пр. гр. Рb3сm) [3], параметры элементарной ячейки a=0,6142(3)нм, с=1,14348(7)нм.
Поскольку
состояние трёхкомпонентной системы выражается четырьмя переменными:
температурой, давлением и двумя параметрами состава и геометрическое
изображение полной диаграммы является четырёхмерным. Для иллюстрации наших
данных мы приводим частную диаграмму системы Ho-Mn-O при 1173К в координатах “состав – давление кислорода“
(рис.1) и её проекцию на плоскость
“катионный состав – давление кислорода” (рис. 2), а также зависимости равновесного
давления кислорода от обратной
температуры (рис.3) для обнаруженных моновариантных равновесий,
последние, на рис.1 показаны горизонтальными треугольниками. Треугольник REA представляет равновесие между Mn2O3, Mn3O4 и HoMn2O5; Треугольник TPG – между Mn3O4,
|
|
|
HoMnO3
и HoMn2O5;
треугольник FOM – между MnO, HoMnO3 и Mn3O4; NKS- между MnO, HoMnO3 и Ho2O3. Вертикальные плоскости на рис.1 показывают бивариантные равновесия в системе. Они
соответствуют областям диаграммы,
приведённой на рис.2. Серия частных диаграмм, подобных изображённой на рис. 1, но |
|
Рис.1. Частная диаграмма системы Ho-Mn-O при 1173К в координатах “состав – давление кислорода.“ Пояснения в тексте. |
|
полученных при разных температурах, образуют полную Р-Т-x диаграмму системы. Однако, для прак- |
тического применения более удобны проекции,
изображённые на рис.2 и 3.

Рис.2. Проекция
частной диаграммы системы Ho-Mn-O при 1173К
(рис.1) на плоскость “катионный состав – давление кислорода” (пояснения в тексте).
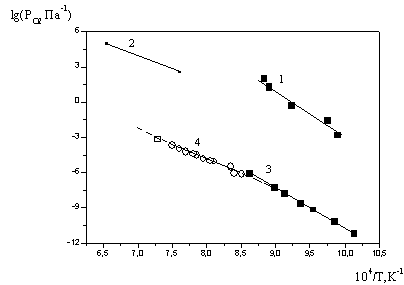
Рис.3.
Зависимости равновесного давления кислорода от обратной темпе - ратуры для обнаруженных моновариантных равновесий. Для равновесия (1):
-■- – наши данные (прямая 1),
(прямая 2) - данные [4]; для равновесия
(2):
-■- – наши данные (прямая 3), -○- - данные [5] (прямая 4), □ –данные
[6],
–
данные [7].
Установлено, что диссоциация исходных оксидов
протекает по реакциям:
HoMn2O5 = HoMnO3 + 1/3 Mn3O4 + 1/3 O2
(1)
HoMnO3 = ½ Ho2O3 + MnO
+ ¼ O2 (2)
Таким образом, в системе Ho-Mn-O в условиях проведенного эксперимента, обнаружено 9 фазовых областей, в которых в равновесии с газовой фазой сосуществуют следующие наборы конденсированных фаз (рис.2): 1 - Ho2O3 + HoMnO3; 2 - HoMnO3 + HoMn2O5; 3 - HoMn2O5 + Mn2O3; 4 - HoMn2O5 + Mn3O4; 5 - HoMnO3 + Mn3O4; 6 - HoMnO3 + MnO; 7 - Ho2O3 + MnO; 8 - Ho2O3 + Mn; 9 – Ho +Mn;
Работа
выполнена с привлечением оборудования ЦКП “Урал М.”
Литература
1.
Янкин А.М., Балакирев В.Ф., Федорова О.М., Голиков Ю.В. Манганиты
редкоземельных и щелочноземельных элементов. Физико-химический анализ.
Екатеринбург: УрО РАН, 2009. ISBN
5-7691-1944-6.
2. Янкин А.М., Балакирев В.Ф., Ведмидь Л.Б., Федорова О.М. Статический метод исследования гетерогенных равновесий // Ж. физ.химии. 2003. Т.77. N11. С.2108-2111.
3.Портной К.И., Тимофеева Н.И. Кислородные соединения
редкоземельных элементов. М.: Металлургия, 1986, 480 с.
4.
H.Satoh, S.Suzuki, K.Yamamoto, N.Kamegashira//J. Alloys Comp., 1996, V.234, N1.
Р.16.
5. Atsumi T.,
Ohgushi T., Namikata H., Kamegashira N. // Journal of Allows and Compounds.
1997. V.252. N1. P.67.
6.Kitayama K.,
Kobayashi M., Kimoto T. // J.Solid State Chem., 2003. V.176 N1. P.151-158.
7.Ewa
Pawlas-Foryst, Krzysztof Fitzner. // J.Chem. Thermodynamics. 2007.V.39.
P.1196-1200.
