УДК:616-005.2:6:615.281.-099:615.32
Синтез и
специфическая активность 3-изоникотиноил-гидразона 18- дегидроглицирретовой
кислоты
Арыстанова Т.А., Махова Е.Г., Ирисметов М.П.
Южно-Казахстанская
государственная медицинская академия
Несмотря на достигнутые успехи в лечении
туберкулеза, на сегодняшний день это заболевание является глобальной
медико-социальной проблемой и предметом активного изучения. Рост заболеваемости
в условиях патоморфоза и нарастания тяжелых, остропрогрессирующих,
полирезистентных форм туберкулеза с одновременным снижением результативности
лечения диктует необходимость создания новых высокоэффективных и безопасных
препаратов.
Широко используемые в химиотерапии туберкулеза лекарственные препараты,
относящиеся к жизненно важным средствам (изониазид, рифампицин) обладают рядом
нежелательных побочных реакций: со стороны печени (гепатотоксичность), ЦНС
(периферические полинейропатии, неврит зрительного нерва, нарушения
чувствительности, энцефалопатия), сердечно-сосудистой системы (артериальная
гипертензия), эндокринной системы (гипергликемия), иммунной системы
(аллергические реакции), ЖКТ (эрозивные гастриты, дискомфорт) [1- 6].
Поиск новых соединений, обладающих высокой активностью
в сочетании с низкой токсичностью привел к использованию природных субстратов,
т.к. трансформированные природные соединения по активности значительно
превосходят нативные вещества [7,8]. В этом
отношении компоненты корня солодки (глицирризиновая кислота, глицирретовая
кислота, 18-дегидроглицирретовая кислота) уникальны, т.к. обладают широким
спектром фармакологической активности: минералокортикоподобным,
противовоспалительным, гепатопротекторным, антиоксидантным, иммунотропным
действием [9]. Для
направленного синтеза в качестве
реакционноспособного синтона нами использована 18-дегидроглицирретовая кислота
(18-ДГЛК, глидеринин) с целью снижения общей токсичности и гепатотоксичности изониазида.
Синтез 18-ДГЛК осуществлен ранее в ИХН МОН РК им. А. Бектурова
(М.П.Ирисметов, 1988) по следующей схеме: 1. Получение кислоты глицирретовой (11) путем гидролиза кислоты
глицирризиновой (1) кипячением в
течение 3-х часов с кислотой хлористоводородной; 2. Очистка (11) путем извлечения хлороформом; 3.
Получение метилового эфира кислоты глицирретовой (111) метилированием последней в сернокислой среде; 4. Получение
метилового эфира 18-дегидроглицирретовой кислоты (1V) бромированием и
дегидробромированием метилового эфира глицирретовой кислоты; 5. Получение
18-ДГЛК (V) из (1V) омылением в спиртовом растворе
калия гидроксида.
Синтез нового соединения 3-изоникотиноил гидразон
18-дегидроглицирретовой кислоты (1Х) проведен по следующей схеме:
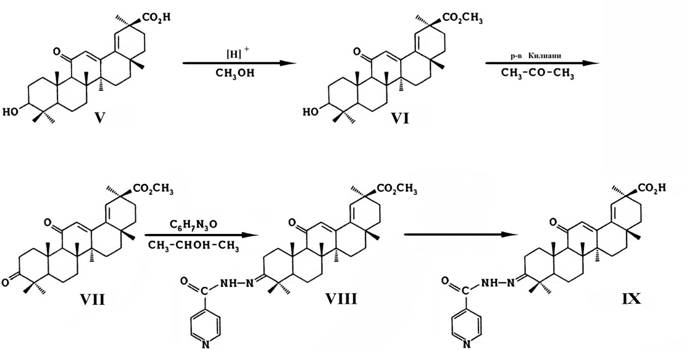
1.Получение метилового эфира 18-дегидроглицирретовой
кислоты (V1). В
круглодонную колбу, снабженную обратным холодильником, помещают 1г 18-дегидроглицирретовой
кислоты (V) и растворяют в 15 мл метанола. Если раствор мутный, его
подогревают и отфильтровывают. К чистому метанольному раствору прибавляют по
каплям 0,5 мл кислоты серной конц. Реакционную массу кипятят в течение 4 часов
на водяной бане. Содержимое колбы выливают в воду, подкисленную кислотой
хлористоводородной (рН 2-3) для кристаллизации, осадок отфильтровывают,
промывают водой до нейтральной реакции, сушат. Перекристаллизацию ведут из
ацетона, выход (V1) составляет 50-55 %.
2. Синтез метилового эфира
3-кето-18-дегидроглицирретовой кислоты (V11).В плоскодонной колбе растворяют
3.Получение метилового эфира 3-изоникотиноил-гидразона
18-дегидроглицирретовой кислоты (V111). В
круглодонной колбе растворяют 1г (1 моль) V11 в 30 мл спирта изопропилового абсолютного, добавляют
4.Получение 3-изоникотиноил-гидразона
18-дегидроглицирретовой кислоты (1X). К полученному V111 прибавляют 30 мл 10% раствора калия гидроксида в метаноле, перемешивают и
кипятят в течение 5 часов. По окончании реакции пробу при перемешивании
выливают в емкость с водой, подкисленной кислотой хлористоводородной (рН 2-3)
до выпадения осадка. Окончание реакции контролируют ТСХ. Осадок фильтруют,
промывают водой до рН 6-7, сушат. Выход 1Х составляет 50 %.
Экспериментальная химическая часть
Ход реакций синтеза и однородность полупродуктов и
продуктов синтеза контролировали ТСХ. В работе использовали прибор для проведения
ТСХ (Россия), УФ хроматоскоп, Rf определено в
системе растворителей бензол:этанол (10:3) на
пластинках «Сорбфил УФ-254», (15х15, Россия), пятна обнаруживали в УФ - свете
при длине волны 254 нм и парах иода. Тпл установлена на приборе ПТП (Россия). Уф-спектры регистрировали на СФ-2000 с программным
обеспечением (Россия). Изучение спектральных характеристик УФ-спектров
1Х в системах кислого, нейтрального и
основного характера показало, что выраженный максимум поглощения наблюдается в
щелочной среде при длине волны 293±2 нм,
удельный показатель поглощения равен 256,3
ИК-спектры
сняты на спектрофотометре ИКС-29 ЛОМО (Россия) с призмами KBr и NаCl, образцы готовили в виде
суспензии в вазелиновом масле. Физические и химические характеристики 1Х определены на 5 сериях лабораторных
образцов (таблица 1).
Таблица 1
Физические и химические характеристики глиниазида
|
Выход, % |
Тпл, °оС |
Брутто формула |
Уф-спектры, нм |
Rf,, мм под- вижная фаза бензол: этанол, 10:3 |
ИК-спектры, Ö, см-1 |
|
50 |
135- 140 |
С 36Н48 N3 О4 |
293 ± 2 |
0,44 |
3350 (NH) 2275-2250 (N=C) 1740 (-СООМе) 1690 (С=С-С=C-C=О) 1379(пиридиновый
цикл) 766 (атомы Н ароматического цикла) |
Сопоставленный анализ физических и химических характеристик исходных соединений и целевого продукта свидетельствует об образовании 3-изоникотиноил гидразон 18-дегидроглицирретовой кислоты
Экспериментальная фармакологическая
часть
Исследование
туберкулостатической активности лабораторных образцов 1Х проводили в сравнении с изониазидом. Бактерицидную активность определяли “in vitro” на музейном штамме Н 37 ку микробиологическим методом двукратных серийных разведении в жидкой среде Школьникова. В
каждую опытную и контрольную пробирки (питательная среда без препарата) вносили
по 0,1мг взвеси микобактерий туберкулеза в 0,2мл физиологического раствора.
Пробирки инкубировались при 37°С в течении 10 суток.
Через 10 дней инкубации на жидкой среде осадки отмывались физиологическим раствором и засевали на среду
Левенштейна-Йенсена. Учет роста культур проводился через 1 мес. Опыт проводился
в 6-х повторностях. Минимальная концентрация, подавляющая рост микобактерий для
субстанции 1Х и изониазида, составила 0,1 мкг/мл, что
свидетельствует о сохранении туберкулостатической активности изониазида в
составе нового соединения.