К.б.н.
Шилина М.В., к.ф.-м.н. Маркова Л.В.
Витебский
государственный университет им. П.М.Машерова,
г. Витебск, Республика Беларусь
Использование КОМПЬЮТЕРНого
МОДЕЛИРОВАНИя для изучения возникновения мембранных потенциалов
Мембранные потенциалы подразделяются на
потенциалы покоя и потенциалы действия.
Потенциал покоя - стационарная разность электрических
потенциалов, регистрируемая между внутренней и наружной поверхностями мембраны
в невозбужденном состоянии.
Потенциал покоя определяется разной концентрацией
ионов по разные стороны мембраны и диффузией ионов через мембрану.
Если концентрация какого-либо иона внутри клетки Свн
отлична от концентрации этого иона снаружи Снар и мембрана проницаема
для этого иона, возникает поток заряженных частиц через мембрану, вследствие
чего нарушается электрическая нейтральность системы, образуется разность
потенциалов внутри и снаружи клетки jм = jнар - jвн которая будет препятствовать дальнейшему
перемещению ионов через мембрану. При установлении равновесия выравниваются
значения электрохимических потенциалов по разные стороны мембраны: mвн = mнар.
Так как m = m0
+ RTlnC
+ ZFj,
то
RTlnCвн
+ ZFjвн = RTlnCнар
+ ZFjнар
Отсюда легко получить формулу Нернста для равновесного
мембранного потенциала
jм = jнар-
jвн = - RT/ZF´ln(Cвн/Снар) (1)
Если мембранный потенциал обусловлен переносом ионов К+,
для которого [К+]вн > [К+]нар
и Z = +1, равновесный мембранный потенциал
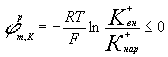 .
.
Таким образом, потенциал покоя на самом
деле ближе к потенциалу, рассчитанному по формуле Нернста для К+.
Вместе с тем, обращает на себя внимание значительное расхождение
экспериментальных и теоретических значений. Причины расхождения в том, что не
учтена проницаемость мембраны для других ионов. Одновременная диффузия через мембрану ионов К+, Na+
и С1- учитывается уравнением Гольдмана.
Уравнение Гольдмана можно вывести из
уравнения Нернста-Планка.
![]() . (2)
. (2)
![]()
В числителе выражения, стоящего под знаком
логарифма, представлены концентрации [К+]ВН, [Na+]BH, но [С1-]НАР, а в знаменателе - [К+]НАР,
[Na+]HАР, но [С1-]ВН, так как ионы хлора
отрицательно заряжены.
В состоянии покоя проницаемость мембраны
для ионов К+ значительно больше, чем для Na+, и больше, чем для С1-:
PK>>PNa, PK>PNa.
Для
аксона кальмара, например,
PK:PNa:PCl=1:0,04:0,45.
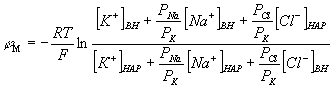 ,
,
в
случае, когда проницаемость мембраны для ионов натрия и хлора значительно
меньше проницаемости для калия:
PNa <<
PK, PCl<<
PK,
Таким образом, уравнение Нернста - частный
случай уравнения Гольдмана.
Мембранный потенциал, рассчитанный по уравнению Гольдмана,
оказался по абсолютной величине меньше мембранного потенциала, рассчитанного по
формуле Нернста» ближе к экспериментальным его значениям в крупных клетках. И
формула Нернста, и уравнение Гольдмана не учитывают активного транспорта ионов
через мембрану, наличия в мембранах электрогенных (вызывающих разделение
зарядов, а следовательно и возникновение разности потенциалов) ионных насосов,
играющих важную роль в поддержании ионного равновесия в мелких клетках. В
цитоплазматической мембране работают К+-Nа+-АТФазы, перекачивающие калий
внутрь клетки, а натрий из клетки. С учетом работы электрогенных ионных насосов
для мембранного потенциала было получено уравнение
Томаса:
![]() , (3)
, (3)
где m -
отношение количества ионов натрия к количеству ионов калия, перекачиваемых
ионными насосами через мембрану. Чаще всего К+-Nа+-АТФаза работает в режиме,
когда m = 3/2, m всегда
больше 1. (Нет ионных насосов, перекачивающих Сl , поэтому в уравнении Томаса отсутствуют члены РСl [Сl-].)
Коэффициент m > 1 усиливает вклад градиента
концентрации калия в создание мембранного потенциала, поэтому мембранный
потенциал, рассчитанный по Томасу, больше по абсолютной величине, чем
мембранный потенциал, рассчитанный по Гольману, и дает совпадение с
экспериментальными значениями для мелких клеток.
Нарушение биоэнергетических процессов в
клетке и работы K+-Na+-АТФазы приводит к уменьшению |φм|, в этом случае мембранный
потенциал лучше описывается уравнением Гольдмана.
Повреждение клеточной мембраны приводит к
повышению проницаемости клеточных мембран для всех ионов: к повышению и Pк, и PNa, и Pсl Вследствие
уменьшение различия проницаемостей абсолютное значение мембранного потенциала
|φм| снижается.
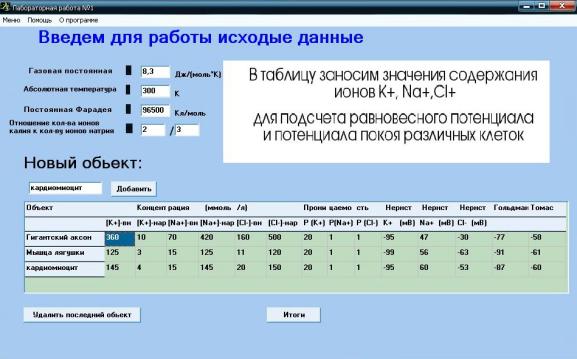
Данная лабораторная работа позволяет
моделировать величину мембранного потенциала в зависимости от концентраций
ионов К+, Na+ и С1-
внутри клетки и снаружи, учитывать различия в проницаемости мембраны, в
состоянии физиологического покоя и при возбуждении, и работу К+-Nа+-АТФазы