Химия и химические технологии/7. Неорганическая химия
К.х.н. Пожидаева
С.Д., аспирант Сотникова Д.А., аспирант
Елисеева А.Ю., д.х.н. Иванов А.М.
Юго-Западный
государственный университет, Россия
Влияние добавок минеральных кислот и хлоридов
металлов на коррозионное поражение меди в 2,1н. растворе уксусной кислоты в
присутствии оксида меди (II) как окислителя.
Ранее было показано [1],
что система уксусная кислота – оксид меди (II) по своей
эффективности в коррозионном поражении
меди в десятки раз уступает не только хлориду меди (II), но и многим другим
солям этого металла. Представляло интерес выяснить, можно ли в такой среде
существенно увеличить скорость расходования металла и, если да, то каким образом.
Эксперимент проводили в
соответствии с пооперационной схемой, описанной в работе [1]. Изменения в ней
коснулись только загрузки реагентов: загружались медь (или её сплав), уксусная
кислота, вода как растворитель, оксид меди (II) и добавка. Барботаж воздуха
не использовался. Не применялись и какие-либо ограничения на контакт
реакционной смеси с атмосферой. Для обеспечения более быстрого измельчения
твёрдой фазы СuO процесс проводили в бисерной мельнице вертикального типа со
стеклянным бисером в качестве перетирающего агента. Массовое соотношение
стеклянного бисера и загрузки (кроме меди)
1,25:1. Скорость вращения механической мешалки 3000 об/мин.
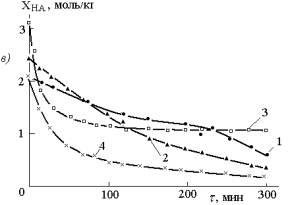
На рис. 1 представлены
кинетические кривые расходования кислоты (суммы кислот) и накопления соединений
меди (II) (СuO выбранным анализом не
определяется и определению других соединений меди (II) не мешает [2]) и меди
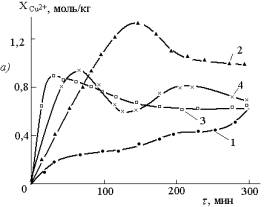
(I). Хорошо видны существенные различия между ними. Прежде
всего следует обратить внимание на то, что в присутствии добавок существенно увеличивается
скорость накопления соединений меди (II), что является результатом
ускоренного взаимодействия оксида меди (II) с кислотой(ами). Это
можно наблюдать и органолептически по исчезновению чёрной окраски мелкораздробленного
суспендированного СuO. В отсутствии добавок чёрный цвет реакционной
смеси сохраняется на протяжении всего протекания процесса. А при использовании
эффективно работающей добавки к 60 мин он обычно исчезает.
Этому способствуют два
фактора: 1 – наличие в системе металлической меди [3], и 2- использование стимулирующей добавки. В отдельных случаях
|
|
|
|
|
|
Рис.1.
Кинетические кривые накопления соединений меди (II) (а), меди (I)
(б) и расходования кислоты (в) при взаимодействии 0,85 моль/кг СuO
с 2,1 моль/кг уксусной кислоты в присутствии 30% от массы остальной загрузки
металлической меди в отсутствие (1) и в присутствии 0,5 моль/кг HCl
(2) 0,93 моль/кг HBr (3) и 0,5 моль/кг NH4Cl
(4); температура 25±1ºС |
|
количество накапливающихся в системе
соединений меди (II)
на глубоких стадиях значительно превышают начальное содержание СuO.
Последнее является следствием окисления металла соединениями меди (II)
с образованием соединений меди (I) и их дальнейшим и
быстрым окислением растворённым кислородом в соединения меди (II).
Этот процесс протекает с переменной и сильно зависящей от многих факторов
скоростью, в том числе и от абсорбции кислорода из газовой фазы. Об этом
свидетельствует и сложный характер кинетических кривых накопления соединений
меди (I) изобилующих максимумами и минимумами различной величины (рис.1).
Иногда
кинетическая кривая накопления соединений меди (I) резко взмывает вверх, достигая
значений 0,55 моль/кг. Это связано с аномально плохим их окислением молекулярным
кислородом (кривая рис.1, добавка HBr). В таком случае кинетическая кривая накопления
соединений меди (II)
достигает своего максимума ![]() и далее монотонно
убывает. Снижение концентрации соединений меди (II) может происходить и за счёт
образования основной соли типа CuA2∙3Cu(OH)2, которая из-за плохой
растворимости в реакционной смеси выбранным анализом на Cu2+ -соединения
не определяется [2].
и далее монотонно
убывает. Снижение концентрации соединений меди (II) может происходить и за счёт
образования основной соли типа CuA2∙3Cu(OH)2, которая из-за плохой
растворимости в реакционной смеси выбранным анализом на Cu2+ -соединения
не определяется [2].
Всё сказанное выше можно
описать следующей последовательностью реакций (НА – уксусная и (или) вводимая
кислота):
СuO + НА → Cu(OH)A ![]() CuA2 + H2O,
CuA2 + H2O,
2 Cu(OH)A + 2Сu → 2CuA (или Cu2A2) + Сu2O + H2O
CuA2 + Cu → 2CuA (или Cu2A2)
Сu2O + 2НА → 2CuA (Cu2A2)
Cu2A2 + 1,5О2 + 2НА → 2CuA2
+ H2O
4CuA + 3H2O + 1,5О2 + Cu → CuA2∙3Cu(OH)2
+ CuA2
2Cu2О + 2НА + О2 +
2H2O → CuA2∙3Cu(OH)2 и т.д.
Сведения
о средней скорости расходования меди в зависимости от концентрации добавляемой
соляной кислоты и хлорида аммония приведены на рис. 2 и 3. Хорошо видно, что
рост Wср зависит от концентрации кислоты и по ней
|
|
|
|
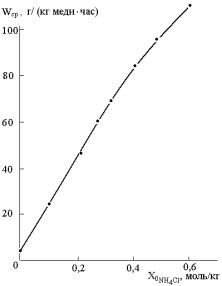
Рис. 2. Средняя в
течение 5 часов скорость расходования меди в зависимости от концентрации
добавляемой соляной кислоты при прочих условиях кривой 2 рис.1. |
Рис.3. Средняя в
течение 5 часов скорость расходования меди в зависимости от величины
начальной добавки хлорида аммония при прочих условиях кривой 1 рис.1 |
меняется по типу кривой
запределивания. На этом же рисунке отдельными точками на проходящей через
концентрацию кислоты 0,25 моль/кг вертикали приведены средние скорости
расходования меди в течение 5 часов при добавках 0,25 моль/кг отдельных
хлоридов вместо соляной кислоты. Хорошо видно, что эффективность большинства из
них выше, чем соляной кислоты (точка 4 рис. 3). Причём хлориды двухвалентных
металлов более эффективны, чем одновалентных, а трёхвалентных чем
двухвалентных. Справа нанесены точки для смесей СН3СООН с HBr, HNO3 и HF. Хорошо видно, что такие
комбинации значительно менее эффективны.
Приведённые данные
показывают, что при контакте меди с водными растворами уксусной кислоты
коррозионное поражение металла может быть достаточно большим. Этому, в
частности, способствует использование в качестве добавок хлоридов металлов, причём
не только щелочных и щелочноземельных, но и поливалентных, способных в водных
средах подвергаться гидролизу.
Ясно
и то, что соединения меди (I) в большинстве случаев
оказываются промежуточными продуктами с соизмеримыми скоростями образования и
расходования.
Аналогичные, по крайней
мере в качественном плане, данные получены при замене меди на бронзу и латунь.
1.Пожидаева, С.Д.
Циклическая макростадия в механизме низкотемпературного гетерогенного
гетерофазного окисления меди при её контакте с кислыми растворами солей меди (II)
[Текст]/ С.Д. Пожидаева, А.М. Иванов, А.Ю. Елисеева, Д.А, Сотникова// Veda a: krok do budoucnosti-2012: сб. матер. Междунар. науч.
– практ. конф. Прага,2012. С. 45-48.
2. Пожидаева, С.Д.
Текущий и выходной анализ в процессах взаимодействия оксида и гидроксида меди (II)
с концентрированными растворами минеральных кислот/ С.Д. Пожидаева, А.М.
Иванов, Д.А, Сотникова, А.Ю. Елисеева. Известия ЮЗГУ. Курск.2012 №1(40). Ч.1.
С. 241 – 247.
3.
Пожидаева, С.Д. Взаимодействие оксидов металлов с кислотами в модельных условиях
и в качестве промежуточной стадии сложных окислительно-восстановительных
процессов/С.Д. Пожидаева, А.М. Иванов, А.Ю. Елисеева, Д.А, Сотникова. Известия
ЮЗГУ. Серия физика и химия. Курск. 2011 №2. С. 38 – 45.