УДК
543:541.1.
Д.х.н., профессор Салькеева Л.К., Минаева Е.В., Жортарова
А.А., Шайхутдинов В.М., Муратбекова А.А., Салькеева А.К.
Карагандинский
государственный университет им. Е.А.Букетова, Казахстан (E-mail:lsalkeeva@mail.ru)
Особенности реакции
фосфорилирования производных 2-амино-4-фенилтиазола и 2-аминобензотиазола
Синтез фосфорилированных производных тиазолов
представляет значительный теоретический и практический интерес, оставаясь, тем
не менее, мало изученной областью исследования. Анализ литературных данных показал, что наличие в молекулах органических
соединений атомов фосфора, азота и серы обуславливает их высокую
физиологическую активность, зачастую приводя к снижению токсичности. Подобные
соединения, обладающие бронхолитическим, противовирусным,
противовоспалительным, противоопухолевым и другим действием, прочно вошли в
арсенал эффективных лекарственных препаратов[1-4].
В то же время
конструирование молекулы потенциально биологически активного вещества таким
образом, чтобы оно в дополнение обладало комплексообразующими свойствами,
способно не только расширить ассортимент, но и границы применения подобных
соединений, как для нужд медицины, так и техники, сельского хозяйства [5-7].
В качестве
объектов исследования с целью синтеза интересных в практическом отношении были выбраны 2-амино-4-фенилтиазол и
2-аминобензотиазол.
Синтезированные 2-амино-4-фенилтиазол и аминобензотиазол служат
прекурсорами в синтезе 2-амино-4-фенил-5-бромтиазола (I) и 2-амино-6-бромбензотиазола (II) соответственно.
Присутствие
аминогруппы в кольце тиазола и бензотиазола способствует реакциям
электрофильного замещения. Структура полученных веществ (I),
(II) доказываются данными ЯМР 1H-спектров.

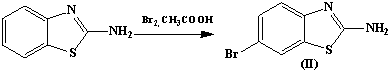
(I): Спектр ЯМР 1H (DMSO),
S,m.g.: 7,654-7,307 м (С6Н5,
2Н, JHH, 7,5 Гц), 7,479-7.441 м (С6Н5,
3Н , JHH, 7,5 Гц ), 1,889 м (NH2,2H);
(II):Спектр ЯМР 1H (DMSO),
S,m.g.:1,906 м (NH2, 2H),
7,610 c (H5 бензотиазол, 1Н,),
7,879 c (H4 бензотиазол,1Н). 7,915 c (H7 бензотиазол,1Н).
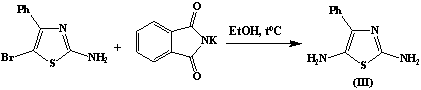
С целью получения диаминопроизводных исследуемых
тиазолов, мы провели нуклеофильное замещение атома брома с использованием
метода Габриэля. Модификация метода заключается в нагревании свободного
фталимида с галогенпроизводным в присутствии этилового спирта с последующим
гидролизом гидроксидом калия замещенного фталимида, приводящего к образованию
соответствующих диаминопроизводных. Структура полученных соединений
2,5-диамино-4-фенилтиазола (III) и
2,6-диаминобензотиазола (IV) доказана данными ЯМР 1H-спектров.
(III): Спектр ЯМР 1H (DMSO),
S,m.g.: 1,87м ( NH2, 2H ),
7.460 - 7,390 м (С6Н5, 3Н , JHH 7,3 Гц ), 7,640-7,520м
(С6Н5, 2Н, JHH 7,5 Гц ), 8,159 - 8,190
м (NH2, 2H );
(IV): Спектр ЯМР 1H (DMSO),
S,m.g.:1,021 - 1,025 м (NH2,2H),
2,725 м (NH2 , 2H), 7,287 c (H5 бензотиазол,1Н), 7,631 c (H7 бензотиазол,1Н), 7,920
с (H4 бензотиазол 1Н).

В качестве активного
фосфорилирующего агента в реакциях фосфорилирования был использован
диэтилхлорфосфат в присутствии акцептора хлороводорода – триэтиламина. Реакция
проводилась в мягких условиях и привела с хорошим выходом к целевым
дифосфорилированным производным тиазола и бензотиазола (V) и (VI) соответственно.

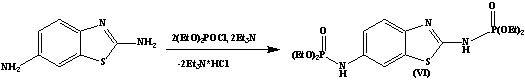
В ИК-спектрах соединений
(V) и (VI) имеются полосы поглощения в области 3381см-1 и 3389см-1
характерные для (N-H) -
группы и в области 1264см-1 и 1284см-1, характерные для (P=O) –
группы.
Согласно литературным данным ранее не
рассматривалась попытка провести фосфорилирование в тиазольное или
бензотиазольное кольцо реакцией бимолекулярного нуклеофильного замещения, что
может привести непосредственному введению фосфорильной группы в одну стадию с
использованием активного нуклеофильного агента – натриевой соли фосфористой
кислоты.
Используя эту возможность, нам удалось
достаточно эффективно ввести диалкилфосфоновую группу в 5-положение соединения
(VII) и 6-положение соединения (VIII).
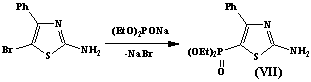

В ИК-спектрах соединение(VII)
и (VIII) присутствуют полосы поглощения в области 1215см-1 и
1278см-1, характерные для (P=O) –
группы, а также 3650 см1 и 3453 см-1,
характерные для (NH2) - группы
Экспериментальная часть
2-амино-5-бром-4-фенилтиазол (I)
К охлаждаемой смеси 2-амино-4-фенилтиазола 9 г (0,05
моль) и СHCl3 40,9 мл в течение 4 часов при перемешивании прибавляют по каплям 15 г брома в том
же растворителе. При этом выпадает осадок оранжевого цвета, который далее
отфильтровывают. Фильтрат перегоняют. 2-амино-5-бром-4-фенилтиазол представляет собой
кристаллическое вещество желтого цвета. Т.пл.1320С. Выход 4,9 г
(55%).
2-амино-6-бромбензотиазол (II)
К 1,5 г (0,01 моль) 2-аминобензотиазола в 15 мл ледяной
уксусной кислоте добавляют при 20°С раствор 1,6 г (0,01 моль) брома в 10 мл
того же растворителя. Реакционный раствор разбавляют водой, происходит почти
полное его обесцвечивание. Основание выделяют добавлением аммиака. Выпавший осадок
отфильтровывают, промывают водой и сушат. Т.пл. 211°С. Выход 1,2 г (86%)
2,5-диамино-4-фенилтиазол (III)
В круглодонной колбе емкостью 100 мл, снабженной
обратным холодильником, на песчаной бане нагревают 2,55г (0,01 моль)
2-амино-5-бром-4-фенилтазола и 1,85 г (0,01 моль) фталимида калия до
температуры 120 – 200
ºС. Реакцию ведут до выпадения белого кристаллического осадка КBr. Выпавший осадок отфильтровывают.
К фильтрату добавляют 0,48г (0,01 моль) раствора КOH и продолжают
нагревание. Выпавший осадок 2,5-диамино-4-фенилтиазол,
представляет собой кристаллическое вещество слегка желтого цвета. Т.пл. 2320С.
Выход 1,4 г (56%).
2,6-диаминобензотиазол (IV)
В двугорлой колбе емкостью 100 мл, снабженной
обратным холодильником, на песчаной бане нагревают 2,29г (0,01 моль) 2-Амино-6-бромбензотиазол и 1,85
г (0,01 моль) фталимида калия до температуры 120 – 200 Сº. Реакцию ведут
до выпадения белого кристаллического осадка KBr. Далее осадок KBr
отфильтровывают. К фильтрату добавляют 0,48 г (0,01 моль) раствора КOH и
продолжают нагревание. Выпавший осадок
отфильтровывают, 2,6-диаминобензотиазола предтавляет собой
кристаллическое вещество белого цвета. Т. пл. = 2300С Выход 1,5 г (65%)
2-амино-4-фенил-5-диэтилфосфонотиазол (V)
В трехгорлую колбу помещают 5,8 г (0,023 моль) 2-амино-4-фенил-5-бромтиазола в 100 мл абсолютного
бензола и этилацетата в соотношений 10:1. Затем при комнатной
температуре с помощью капельной воронки прикапывали 17 мл (0,023моль) натриевую соли диэтилового
эфира фосфористой кислоты, затем смесь нагревали при температуре не выше 60ºС. Выпавший осадок бромида натрия отфильтровывают.Полученное белое
кристаллическое вещество. Т.пл. 2500С. Выход 2,3 г (35%.)
2-амино-6-диэтилфосфонобензотиазол (VI)
В трехгорлую колбу помещают 5,2 г (0,023 моль) 2-амино-4-фенил-5-бромтиазола в 100 мл абсолютного
бензола и этилацетата в соотношений 10:1. Затем при комнатной
температуре прикапывали 17 мл (0,023 моль) натриевую соли диэтилового эфира
фосфористой кислоты, затем смесь нагревали при температуре не выше 60ºС. Выпавший осадок бромида натрия отфильтровывают. Полученное белое
кристаллическое вещество. Т.пл. 2380С. Выход1,9 г (38%.)
Литература:
1.Лесник
Р.Б., Громовик Б.П., Атаманюк Д.В., Субтельна Л.Ю., Соронович П. Современные подходы к моделированию лекарственных
препаратов // Фармацевтический журнал. 2002. №2. С. 33-39.
2.Racane L., Stojkovic R., Tralic-Kulenovic V.,
Karminski-Zamola G. Synthesis and Antitumor Evaluation of Novel Derivatives of
6-Arnino-2-phenylbenzothiazoles // Molecules. 2006. V. 11. P. 325-333.
3.Драч Б.С., Лобанов О.П. Новый синтез
фосфорилированных тиазолов. - ЖОХ. - 1978. - Т. 48, № 9. - С.
1994-1997.
4.Разводовская Р.В.,
Грапов А.Ф., Орлов С.И., Хасаньянова Э.Ш., Мельников Н.Н. Фосфорилированные
аминотиазолы, аминотиазолины и аминоимидазолины
// ЖОХ. - 1979.
-Т. 50, № 2. - С. 329-336.
5.Ремизов А.С., Корелева Т.И., Промоненков В.К.,
Грапов А.Ф. Синтез новых фосфоналкилированных гетероциклов // ЖОХ. – 1981. – Т.
51, № 2. - С. 341.
6.Прокофьева А.Ф.,
Алешникова Т.В., Негребецкий В.В., Грапов А.Ф. Фосфоналкилированные
2-аминотиазолы // ЖОХ. - 1984. - Т. 54, № 3. - С. 525-530.
7.Turan-Zitouni G., Demirayak §., Ozdemir A.,
Kaplancikli Z.A., Yildiz M.T. Synthesis of Some
2-(Benzazole-2-yl)thioacetylamino.thiazole Derivatives and Their Antimicrobal
Activity and Toxicity // Eur. J. Med. Chem. 2004. V. 39. P. 267-272.