Медицина/14. Анестезиология и
реаниматология
Шматова
А.А., Кострова Е.М.
УО «Белорусский государственный медицинский
университет», кафедра анестезиологии и реаниматологии, г. Минск
Влияние вида
анестезиологического пособия при абдоминальном родоразрешении на мембранные
свойства эритроцитов у беременных женщин с гестозом
Гестоз является одним из
осложнений беременности, причиной материнской и перинатальной заболеваемости и
смертности, а также инвалидизации новорожденных. Частота встречаемости гестоза составляет от 15,7 до 30,5% [9].
Пусковым механизмом в
развитии и прогрессировании гестоза являются нарушения реологических и
коагуляционных свойств крови [5, 10]. Патологические нарушения при гестозе
начинаются с изменений в сосудисто-тромбоцитарном звене. Маркером эндогенной
интоксикации (ЭИ) организма любого являются молекулы средней массы (MCM)
[1, 3, 4, 6, 7, 8].
МСМ повышаются в крови беременных женщин после проведения
оперативного вмешательства кесарева сечения (КС), в том числе и анестезии,
вызывая взаимосвязанный метаболический, гормональный и гемодинамический ответ с
образованием промежуточных метаболитов [7, 8].
При повреждении эндотелия происходит снижение деформирующей
способности эритроцитов, что способствует нарушению микроциркуляции.
Деформируемость эритроцитов (ДЭ) формирует кислородтранспортную функцию крови и
обеспечивает функционирование системы транспорта кислорода [2, 11].
В настоящее время
отмечается увеличение частоты проведения КС у беременных 52-90% [1, 3].
Операционная травма, а также медикаменты, применяемые во время и после
операции, в том числе и анестетики
(закись азота, севофлюран) влияют на мембранные свойства эритроцитов. Как компоненты общей анестезии, так и
регионарные методы анестезии (преганглионарная блокада) влияют на реологические
свойства крови, снижая вязкость крови как на этапах анестезии, так и в
послеоперационном периоде [11, 12].
Цель исследования: оптимизировать методику
анестезиологического обеспечения при оперативном родоразрешении у беременных
женщин с гестозом при кесаревом сечении.
Задачи исследования:
1.
Изучить
динамику изменения ЭИ (уровень MCM)
у беременных женщин с поздним гестозом при абдоминальном родоразрешении при
различных видах анестезии.
2.
Сравнить
в динамике изменения ДЭ у беременных женщин с поздним гестозом и у беременных
женщин без гестоза при МСА и СА.
Материалы и методы.
Нами обследовано 90 беременных женщин в возрасте от 21 до 39
лет, которым в период с 2010 по 2011 гг. в УЗ «6-я ГКБ» г. Минска выполнялась
операция КС.
Для решения поставленных задач, пациентки, родоразрешенные
путем КС, были разделены на 2 группы: 1-я группа – 45 беременных женщин без
гестоза; 2-я группа – 45 беременных женщин с гестозом. Среди пациенток 2-й
группы: 32 пациентки (71,1%) имели легкую степень и 13 (28,9%) имели среднюю
степень тяжести течения гестоза по шкале C.Goec в модификации Г.М.Савельевой
[1]. 3-ю группу (сравнения) составили небеременные женщины без сопутствующей
экстрагенитальной патологии (n=20).
Исследуемые группы (1-я и 2-я группа) были сопоставимы по
основным демографическим показателям, характеру сопутствующей патологии, классу
тяжести по ASA, виду и продолжительности анестезии.
Для МСА проводилась с использованием
закисно-кислородной смеси с элементами нейролептаналгезии. СА проводилась раствором бупивакаин-спинал.
Оценка адекватности местного обезболивания осуществлялась по
визуально-аналоговой шкале [13].
Исследование осуществлялось на следующих этапах: I этап - за 10-15 минут до начала операции, II этап - на следующие сутки, III этап - 3-е сутки и IV этап - 5-е сутки после оперативного родоразрешения.
Степень ЭИ определяли путем оценки
уровня МСМ в сыворотке крови по методу Н.И. Габриэлян и др. (1983) с
использованием спектрофотометра СФ 46 [4]. При исследовании ДЭ определялся
индекс деформируемости эритроцитов (ИДЭ) по методу З.Д. Федорова (1986) [8].
Все полученные данные
были обработаны методами вариационной статистики на персональном компьютере с
помощью пакета прикладных программ STATISTICA v.
6.0.
Результаты и обсуждение.
Уровень MCM в 1-й группе на I этапе исследования при МСА составил 0,31(0,27-0,34), а при СА - 0,26(0,25-0,28), достоверно превышая данный показатель на 29,2% и 8,3% соответственно (p<0,05).
На II этапе исследования в 1-й группе отмечалось достоверное увеличение уровня MCM, по сравнению с дооперационным уровнем: при МСА 0,36(0,32-0,36) и при СА 0,30(0,29-0,34).
На III этапе происходило снижение данного показателя по сравнению с II этапом исследования, как при СА, так и при МСА на 6,67% и 2,23%.
На IV этапе в 1-й группе
уровень MCM составил 0,33(0,3-0,4) и 0,27(0,26-0,3) при МСА и
СА соответственно, что было немного выше дооперационного уровня, но
статистически эта динамика не подтверждена (p>0,05) (рис.1).
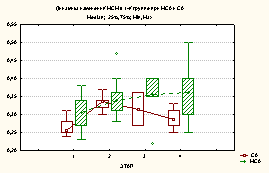

Рисунок
1. Изменение уровня МСМ по этапам в 1-й и 2-й
группе при МСА и СА
Во 2-й группе уровень МСМ на I этапе
при МСА и при СА составил соответственно 0,44(0,42-0,46) и 0,43(0,4-0,47),
достоверно превышая данный показатель в контрольной группе соответственно на
83,3% и 79,2% (р<0,001).
На II этапе исследования во
2-й группе отмечается статистически достоверное увеличение данного
показателя по сравнению с
дооперационным уровнем при МСА на 9,1% и составил 0,48(0,47-0,5) (p<0,05),
а при СА данный показатель составил 0,44(0,4-0,48), однако достоверной разницы
не отмечалось (p>0,05).
На III этапе исследования во
2-й группе уровень MCM составил 0,46(0,4-0,55)
при МСА и 0,34(0,35-0,38) при СА и был достоверно ниже, чем на II
этапе (p<0,05).
К IV этапу во 2-й группе
уровень MCM оставался на прежнем уровне у пациенток, которым
было проведено оперативное родоразрешение
под МСА и был достоверно ниже при СА (p<0,05).
Более быстрое снижение уровня MCM у пациенток, которым проводилась СА при КС, объясняется адекватной антиноцицептивной защитой и менее выраженной интоксикацией.

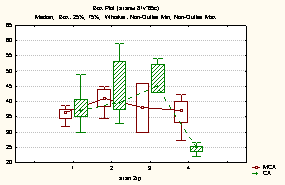
Рисунок 2.
Изменение уровня ИДЭ
по этапам в 1-й и 2-й группе при МСА и СА
Уровень
ИДЭ в 1-й группе на I этапе исследования при
МСА составил 25(21-27), а при СА – 26,7(19,2-28) превышая уровень ИДЭ в
контрольной группе, однако при сравнении не выявило статистической разницы (p>0,05).
На II
этапе исследования в 1-й группе отмечалось статистически достоверное увеличение
ИДЭ, достигая своего максимума, по сравнению с дооперационным уровнем: при МСА
31(26-34) и при СА 29,7(25,5-34,5). Начиная с 3-х суток после операции
происходило снижение данного показателя по сравнению с II этапом исследования, как
при СА, так и при МСА на 7,8% и 8,4% соответственно.
На IV этапе в 1-й группе ИДЭ
составил 24,5(21,5-29) и 25,9(18-27) при МСА и СА соответственно, что было
немного выше дооперационного уровня, но при статистической оценке достоверной
разницы получено не было (p>0,05) (рис.2).
Во 2-й группе ИДЭ на I этапе при МСА и при СА
составил соответственно 36,5(34,5-37,6) и 37,1(35-40,6), достоверно превышая
данный показатель в контрольной группе на 47,2% и 49,6% соответственно (р<0,001), что можно объяснить наличием гестоза (рис.2).
На II этапе во 2-й группе
отмечается статистически достоверное увеличение данного показателя по сравнению с дооперационным уровнем как
при МСА на 20,5% и составил 44(30-46) (p<0,05), так и при СА
-21,5% и составил 0,44(0,4-0,48), однако достоверной разницы между видами
анестезии не отмечалось (p>0,05).
Начиная с
III этапа исследования во 2-й группе, происходит
снижение ИДЭ, более выраженное при СА -
37,2(33,2-40) и 30,25(25,1-33,8) соответственно (p<0,05).
К IV этапу во 2-й
группе уровень MCM оставался на прежнем уровне у
пациенток, которым было проведено КС под МСА и достоверно ниже у пациенток,
которым проводилась СА (p<0,05).
Методом определения
корреляционной зависимости в 1-й и 2-й группах между показателями MCM и
ИДЭ была выявлена достоверная отрицательная корреляционная зависимость на всех
этапах исследования r=-0,52, т.е. увеличение концентрации MCM
приводит к снижению ДЭ.
Вывод:
СА сопровождается меньшими изменениями
показателей реологических свойств крови и эндогенной интоксикации, что
определяет ее выбор для анестезиологического обеспечения у беременных женщин с
гестозом при КС.
Литература
1. Ан А.В. Материнская летальность после
кесарева сечения// Проблемы репродукции.-2010.-№3.-с.83-86.
2. Афанасьева А.Н. Средние молекулы в оценке уровня
эндогенной интоксикации при экземе // Клиническая лабораторная диагностика. –
2004. – №6. – с. 11-12.
3. Винников А.В., Мамась А.Н. Системная
гемодинамика у беременных с гестозом при использовании различных видов
анестезии// Актуальные проблемы медицины- Гродно.-2009.-с. 132-134.
4. Габриелян И. И. /Скрининговый метод
определения средних молекул в биологических жидкостях: метод. рекоменд. –
Москва.- 1985. – 20 с.
5. Гурьянов В.А. Единая
концепция совершенствования принципов оценки операционно-анестезиологического
риска, структуризации предоперационной подготовки и компонентности анестезии //
Вестник интенсивной терапии. - 2003. - №2. - с. 9-15.
6. Зильбера А. П.
Клиническая физиология в анестезиологии и реаниматологии –М - 1984
7. Коротких И.Н., Ходасевич Э.В., Бригадирова
В.Ю. Использование низкочастотного магнитного поля в комплексной реабилитации
родильниц после кесарева сечения. // Акушерство и гинекология. - 2009. - №6.
-с. 27-30.
8. Лоуренс Д.Р. и др. Клиническая фармакология
-М:-2002.
9. Савельева Г.М. Кесарево сечение и его роль в
современном акушерстве// Акушерство и гинекология.- 2008.-№3.- с.10-14.
10. Салов И.А. Дисфункция эндотелия как один из
патогенетических факторов расстройств микроциркуляции при гестозе// Российский
вестник акушера-гинеколога
11.Фахрутдинов И.А. Влияние регионарной анестезии на реологические
свойства крови оперированных больных//Казанский медицинский
журнал.-2011.-№2.-с.200-202
12. Olearczyk J.J., et al.
Heterotrimeric G protein Gi is involved in a signal transduction pathway for
ATP release from erytrocytes // Am. J. Physyol. Heart. Circ. Physiol. - 2004. -
v. 286. - №3. - p.Н940-Н945.
13. Breivik H., Borchgrevink P.C.,
Allen S.M., et al. Assessment of pain. British Journal of Anaesthesia 2008; 101
(1): 17–24