К.х.н.
Пожидаева С.Д., д.х.н. Иванов А.М., студент Елисеева А.Ю., аспирант Сотникова
Д.А.
Юго-Западный государственный университет, Россия
Циклическая
макростадия в механизме низкотемпературного гетерогенного гетерофазного окисления
меди при ее контакте с кислыми растворами солей меди (II)
Циклическая
макростадия при гетерогенном окислении металлов способствует не только
повышению скорости расходования металла, но и глубине протекания окислительно-восстановительного
процесса с его участием, причем до такой степени, что данный процесс из
коррозионного поражения металла превращается в технологический процесс
получения конкретных продуктов [1]. Это предопределено тем, что в процессе функционирования
такой макростадии все время возвращается в систему легко и быстро реагирующий с
металлом реагент, например, молекулярный йод или бром [1, 2]. В случае меди возможна
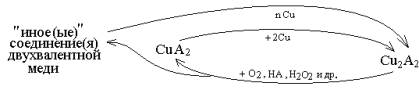
циклическая стадия без использования молекулярного йода - прямое взаимодействие Cu
с CuCl2
в литературе описано
[3, 4]. Схема такой стадии может быть следующая:
|
|
(1) |
Представляло интерес оценить:
1. Какой(ие) «иной(ые)» продукт(ы)
образуются и накапливаются в приведенной выше схеме и как такое накопление
зависит от природы кислоты НА?
2. Насколько эффективность работы такой
схемы зависит от природы кислоты НА?
3. Насколько активно протекает
расходование меди при взаимодействии с «иным» соединением Cu2+?
4. Как изменится
эффективность функционирования такой макростадии, если в системе будет
присутствовать несколько кислот?
5.
Можно ли в обозначенной циклической стадии заменить медь на ее сплав или другой
металл и как это скажется на эффективности ее функционирования?
Эксперимент
проводился в соответствии с представленной ниже пооперационной схемой.
Температура комнатная. Полученные данные сведены в табл.
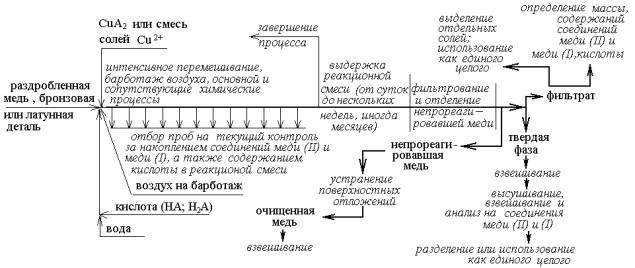
Таблица. Эффективность
основных и средних солей меди (II) в окислении металла в водных растворах; WCu, моль/(кг исходной меди×час)
|
Исходный окислитель меди или смесь окислителей |
Исходная загрузка |
WCu |
|||
|
соединения Cu2+,
моль/кг |
кислота или смесь кислот,
моль/кг |
||||
|
CuА2 |
Cu(ОН)А |
прочие |
|||
|
CuF2 |
0,62 |
- |
- |
НF (1,61) |
0,98 |
|
CuCl2 |
1,03 |
- |
- |
НCl (0,92) |
11,13 |
|
Cu(ОН)Cl |
- |
0,81 |
- |
НCl (1,75) |
6,85 |
|
Cu[CuCl4] |
- |
- |
1,78 |
НCl (0,1) |
8,73 |
|
CuCl2+ Cu(ОН)Cl |
0,57 |
0,85 |
- |
НCl (0,82) |
12,14 |
|
CuCl2+ Cu(ОН)Cl + +CuCl2×3Cu(ОН)2 |
0,31 |
0,52 |
0,43 |
НCl (2,11) |
6,87 |
|
Cu(ОН)Cl+ Cu[CuCl4] |
- |
0,64 |
0,72 |
НCl (0,87) |
8,18 |
|
CuBr2 |
1,27 |
- |
- |
НBr (1,09) |
4,18 |
|
Cu(ОН)Br +CuBr2 |
0,71 |
0,83 |
- |
НBr (1,29) |
4,55 |
|
Cu(NO3)2 |
0,89 |
- |
- |
НNO3(1,37) |
2,58 |
|
Cu(NO3)2+Cu(OH)NO3 |
0,73 |
0,69 |
- |
НNO3(2,74) |
1,72 |
|
CuSO4 |
0,415 |
- |
- |
Н2SO4 |
1,03 |
|
Cu(OCHO)2 |
0,67 |
- |
- |
НСООН (1,27) |
1,05 |
|
Cu(OCHO)2+Cu(OH)OCHO |
0,73 |
0,47 |
- |
НСООН
(1,27) |
1,05 |
|
Cu(OCOCH3)2 |
1,04 |
- |
- |
СН3СООН
(1,41) |
0,37 |
|
Cu(OCOCH3)2+Cu(OH)OCOCH3 |
0,43 |
0,82 |
- |
СН3СООН
(1,05) |
0,72 |
|
Cu(OCOCH3)2
+ + Cu(OH)OCOCH3 + CuО |
0,52 |
0,77 |
0,3 |
СН3СООН
(1,25) |
0,27 |
|
СН3СООН
(1,30); НCl (0,23) |
1,67 |
||||
|
СН3СООН
(1,30); НBr (0,43) |
0,82 |
||||
|
СН3СООН
(1,25); НNO3 (0,5) |
0,54 |
||||
|
СН3СООН
(1,30); NaHSO4 (0,47) |
0,62 |
||||
|
CuО |
- |
- |
0,8 |
СН3СООН
(2.05) |
0,09 |
Разделение конечных
реакционных смесей (суспензий) на фазы с последующим выделением из них
отдельных продуктов показало, что в случае хлорида меди (II) и соляной кислоты в качестве НА «иными»
продуктами циклической стадии (I) являются основные хлориды меди (II) CuCl2×3Cu(OH)2 и Cu(ОН)Cl, а также аддукты Cu[CuCl4], Н[CuCl3] и Н2[CuCl2]. Аналогичные продукты обнаружены и в случае других
исходных солей меди CuА2, но в разном количественном соотношении. Существенное
содержание (от 0,05 и менее до 1,0-1,5 моль/кг) в конечной реакционной смеси и
соединений Cu2А2. Это
свидетельствует о том, что окисление соединений одновалентной меди молекулярным
кислородом идет медленнее, чем непосредственное взаимодействие металла с CuА2 и «иными» соединениями
меди (II). Положение можно существенно исправить путем
дробного ввода концентрированного пероксида водорода. При отлаженной программе
ввода этого окислителя содержание соединений меди (I) можно удерживать в диапазоне 0,025-0,100 моль/кг.
Данные таблицы
относительно средних скоростей WCu показывают, что они, с одной
стороны, довольно высокие, а с другой - существенно зависят от природы
окислителя металла и условий проведения процесса. Из изученных наиболее высокие
WCu получены при использовании среднего и основного хлоридов, а
также их смесей в различном мольном соотношении. Иными словами, изменение
состава реакционной смеси за счет накопления «иных» продуктов циклической
макростадии по ходу процесса не сильно сказывается на эффективности
функционирования самой циклической макростадии (I). К тому же последнюю можно в ряде случаев существенно
ускорить использованием для подкисления смеси ряда должным образом подобранных
кислот. Особенно в случае использования в качестве окислителя металла
карбоксилатов меди (II), где добавка сильной
минеральной кислоты даже в относительно небольших количествах может вызвать
рост WCu в несколько раз.
Таким образом, на
первые 4-е вопроса ответы положительные, что может свидетельствовать о важной
роли рассматриваемой циклической макростадии в механизмах окислительно-восстановительных
процессов с участием меди и соединений меди (II) как окислителей.
Для оценки по 5-му
вопросу вместо меди в качестве реагента были выбраны различные детали бронзы и
латуни (пробковый кран, тройник) и т.д. с массой до 200 г и максимальными
линейными размерами до 70 мм. К тому же из листовой латуни изготавливали
лопасти используемой механической мешалки.
Выполненный эксперимент показал, что в течение 5 часов в зависимости от природы
CuА2 и кислот для
подкисления, испытываемая деталь теряет в весе от 5 до 50 г. При этом при
последовательном перенесении из опыта в
опыт довольно быстро наступает момент количественного расходования всего
сплава выбранной детали. Это однозначно свидетельствовало о том, что в схеме (I) принимают участие
все входящие в выбранные сплавы металлы, причем с соизмеримыми с расходованием
меди (WCu) скоростями.
1. Иванов, А.М. Использование
бисерной мельницы для предотвращения и преодоления самопрекращения
окислительно-восстановительных и иных процессов с участием оксидов переходных металлов
и практические решения на базе
такого подхода [Текст]/ А.М. Иванов, С.Д. Пожидаева. Курск: из-во КурскГТУ,
2008. 316 с.
2. Иванов, А.М. Низкотемпературное гетерогенное
гетерофазное окисление металлов растворенным в жидкой фазе йодом или бромом [Текст]/ А.М. Иванов. Курск, изд-во Курск:
гос. техн. ун-та, 2006. 284 с.
3. Фурман, А.А. Неорганические
хлориды (Химия и технология) / А.А. Фурман. М.: Химия. 1980. 416 с.
4. Мельников Н.Н.
Пестициды. Химия, технология и применение. М.Химия, 1987. 712 с.